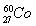题目内容
为清理路面积雪人们使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________。
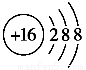
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为________,电子式为________,化学键类型为________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成______,其化学键类型为________;加热时生成______,其化学键类型为________,电子式为________。
(1)CaCl2 离子键 
(2) S=C=S
S=C=S 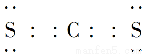 极性共价键
极性共价键
(3)Na2O 离子键 Na2O2 离子键和非极性共价键 
【解析】(1)X的阳离子与Y的阴离子的电子层结构相同,且1 mol XY2中含54 mol电子,则每摩尔X、Y的离子含18 mol e-,可推出其化学式应为CaCl2,即X为Ca,Y为Cl。(2)D、E原子的最外层电子数是其电子层数的2倍,则其为He或C或S或Kr,又因D与Y相邻,则D为S,He、Kr与D不能形成分子,则E为C,C与S形成的分子为CS2。(3)W是与硫同主族的短周期元素,则W是氧;Z是第三周期金属性最强的元素,则Z是Na。Na在O2中反应不加热时生成Na2O,加热时生成Na2O2,Na2O2中Na+与O22-间形成离子键,O22-内部形成非极性共价键。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案