题目内容
| A.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-="2" AlO2-+H2O |
| B.二氧化锰与浓盐酸混合加热:MnO2+2Cl-+2H+=Cl2↑+Mn2++H2O |
| C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
| D.硫酸氢钠溶液中滴入Ba(OH)2溶液使所得溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
A
二氧化锰与浓盐酸反应是氧化还原反应,原子电荷均不守恒,B错;磙性氧化铁要保留化学式,C错;向Ba(OH)2中滴入NaHSO4显中性,则OH-与H+必须按物质的量2:2反应,D中显碱性,D错;答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
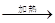 CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
 CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l) 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。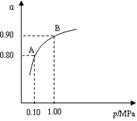
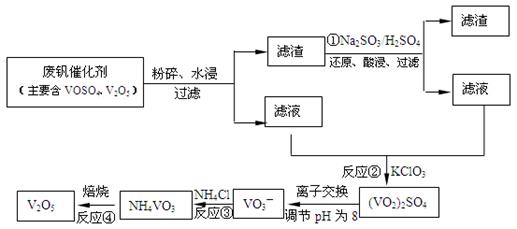
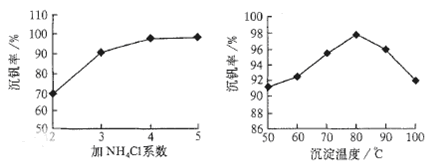
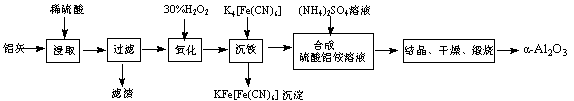
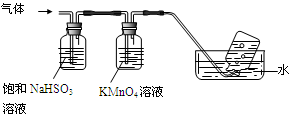
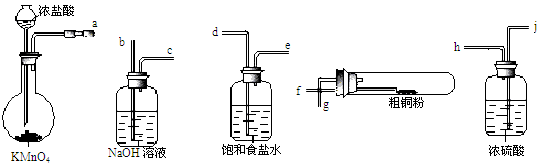
 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。