��Ŀ����
����Ŀ�����������У�SO2����������SO3��2SO2��g��+O2��g��![]() 2SO3��g����H��0
2SO3��g����H��0
��1�����2min��SO2��Ũ����6mol/L�½�Ϊ2mol/L����ô����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ ��
��2��ij�¶��£�SO2��ƽ��ת��������������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ1��ʾ������ͼʾ�ش��������⣺
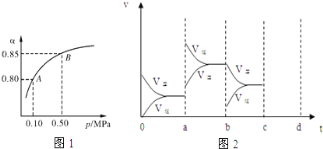
ƽ��״̬��A�䵽Bʱƽ�ⳣ��K��A�� K��B������������������������=������
��3���˷�Ӧ�ں����ܱյ�װ���н��У��ܳ��˵���˷�Ӧ�Ѵﵽƽ��ı�־�� ������ĸ����
A���Ӵ����������ƽ����Է����������ٸı�
B���Ӵ�����SO2��O2��SO3��Ũ����ͬ
C���Ӵ�����SO2��SO3�����ʵ���֮��Ϊ2��1��2
D���Ӵ�����ѹǿ����ʱ��仯���仯
��4��ͼ2��ʾ�÷�Ӧ���ܱ������дﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a�� b�����иı������������ ��b��c�����иı������������ �� ������ѹǿʱ����ѷ�Ӧ���ʱ仯�������c��d����
���𰸡�
��1��1molL��1min��1��2��=����3��AD
��4�����£���СSO3Ũ�ȣ�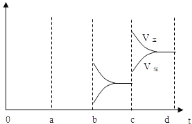 ��
��
��������
�����������1��v��SO2��=![]() =2 molL-1min-1��v��O2����v��SO2��=1��2��v��O2��=
=2 molL-1min-1��v��O2����v��SO2��=1��2��v��O2��=![]() v��SO2��=1molL-1min-1���ʴ�Ϊ��1molL-1min-1��
v��SO2��=1molL-1min-1���ʴ�Ϊ��1molL-1min-1��
��2����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ʣ����淴Ӧ2NO��g��+2CO��g��![]() N2��g��+2CO2��g�� ��ƽ�ⳣ��K=
N2��g��+2CO2��g�� ��ƽ�ⳣ��K=![]() ��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣬��ѹǿ���䣬ƽ��״̬��A�䵽Bʱ����k��A��=k��B�����ʴ�Ϊ��=��
��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣬��ѹǿ���䣬ƽ��״̬��A�䵽Bʱ����k��A��=k��B�����ʴ�Ϊ��=��
��3��A����������������䣬�淴Ӧ���У���������ʵ�����С��ƽ����Է�����������ƽ����Է����������䣬˵������ƽ��״̬����A��ȷ��B��ƽ��ʱ�Ӵ�����SO2��O2��Ũ��һ������ͬ����ʼ���ʵ���Ϊ2��1����2��1��Ӧ��ƽ��ʱ���ߵ����ʵ���֮��Ϊ2��1��Ũ��֮��Ϊ2��1����B����C��ƽ��ʱ�Ӵ�����SO2��O2��SO3���ʵ���֮�ȿ���Ϊ2��1��2�����ܲ���2��1��2������������ת�����йأ���C����D���淴Ӧ���У���������ʵ�����С���Ӵ�����ѹǿ��С��ѹǿ����ʱ��仯���仯��˵������ƽ��״̬����D��ȷ���ʴ�Ϊ��AD��
��4��aʱ�淴Ӧ���ʴ�������Ӧ���ʣ������淴Ӧ���ʶ�����˵��ƽ��Ӧ���淴Ӧ�����ƶ����÷�Ӧ������Ӧ���ȣ�ӦΪ�����¶ȵĽ����bʱ����Ӧ���ʲ��䣬�淴Ӧ���ʼ�С���ڴ˻�������С��ӦΪ��С�������ԭ��������ѹǿʱ��ƽ��������Ӧ�����ƶ��������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ�ͼ��ӦΪ ���ʴ�Ϊ�����£���СSO3Ũ�ȣ�
���ʴ�Ϊ�����£���СSO3Ũ�ȣ�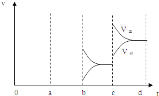 ��
��