题目内容
(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。
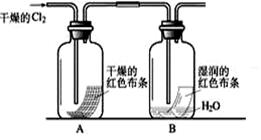
①写出Cl2与水反应的离子方程式 。
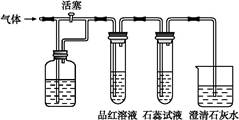
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
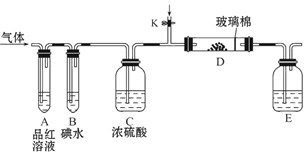
(2)①如图所示,上述实验过程中,不会产生气体的是 ;

②写出反应D的化学方程式 。
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =" 6KCl" + 3I2 + 3H2O,反应的现象是 。

①写出Cl2与水反应的离子方程式 。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
(2)①如图所示,上述实验过程中,不会产生气体的是 ;

②写出反应D的化学方程式 。
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =" 6KCl" + 3I2 + 3H2O,反应的现象是 。
(12分)[每空2分](1)①Cl2 + H2O  H++ Cl- + HClO
H++ Cl- + HClO
②干燥的氯气没有漂白性,氯水有漂白性;[答HClO漂白性等合理即得分]
尾气吸收装置[1分]
(2)①C [1分] ②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(3)① 碘化钾容易在空气中被氧化成单质碘,单质碘易升华
② B [1分] ③溶液变蓝色 [1分]
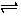 H++ Cl- + HClO
H++ Cl- + HClO②干燥的氯气没有漂白性,氯水有漂白性;[答HClO漂白性等合理即得分]
尾气吸收装置[1分]
(2)①C [1分] ②MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(3)① 碘化钾容易在空气中被氧化成单质碘,单质碘易升华
② B [1分] ③溶液变蓝色 [1分]
试题分析:(1)①氯气与水反应生成氯化氢和次氯酸,其离子方程式为Cl2 + H2O
 H++ Cl- + HClO
H++ Cl- + HClO②A中有色布条不褪色B中有色布条褪色,说明氯气没有漂白性,次氯酸具有漂白性;氯气有毒需进行尾气处理,缺少尾气吸收装置
(2)①A产生氧气,B产生二氧化碳气体,D产生氯气,只有C没有气体产生
②该装置是实验室制氯气的装置,化学方程式为MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(3)①碘离子在空气中易被氧化而生成碘单质,碘易升华,所以损失率高
②萃取剂的选择需与原溶剂不相溶,且溶质在萃取剂中的溶解度较原溶剂中的大,所以只能选B
③碘遇淀粉变蓝色,所以实验现象是溶液变蓝

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
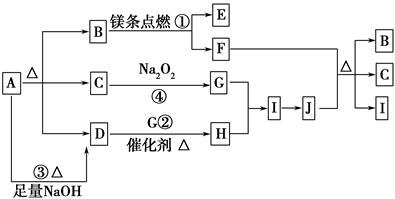
 2MgO+C,请填写以下空白:
2MgO+C,请填写以下空白: