题目内容
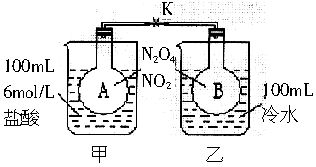
如下图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100mL6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。现向烧杯甲中放入25gNaOH固体,同时向烧杯乙中放入25gNH4NO3固体,搅拌使之溶解。
试回答:
(1)A瓶中气体的颜色________,理由是________。
(2)B瓶中气体的颜色________,理由是________。
见分析
【试题分析】
解析:一要熟悉典型反应的吸热、放热情况,这是解题的依据;二要注意外因的变化情况及其对平衡的影响结果。NaOH与盐酸发生的中和反应为放热反应,使溶液温度升高,A中气体的温度也升高,故使平衡2NO2
 N2O4(正反应为放热反应)向左移动,NO2的浓度增大,气体的颜色变深;NH4NO3溶于水要吸热,溶液的温度降低,B中气体的温度也降低,使上述平衡向右移动,NO2的浓度减小,气体的颜色变浅。
N2O4(正反应为放热反应)向左移动,NO2的浓度增大,气体的颜色变深;NH4NO3溶于水要吸热,溶液的温度降低,B中气体的温度也降低,使上述平衡向右移动,NO2的浓度减小,气体的颜色变浅。 
练习册系列答案
相关题目
过氧 化氢对环境友好,性质多样,有很重要的研究和应用价值。
化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应 可制备氧气。
可制备氧气。
①取等物质的量浓度等体积
 溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
| 序号] | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | 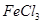 溶液 溶液 | | |
| 2 | 20 | 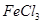 溶液 溶液 | | |
| 3 | 20 | 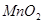 | | |
| 4 | 20 | 无 | | |
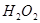 分解速率的影响。
分解速率的影响。实验2、3的目的是____________________________。
实验中可以表明该反应速率差异的现象是______________。
②实验室用
 做该反应的催化剂,使用如下图所示装置的A部分制备
做该反应的催化剂,使用如下图所示装置的A部分制备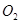 ,避免反应过于剧烈的操作是______________。
,避免反应过于剧烈的操作是______________。
(2)
 与水反应也可生成
与水反应也可生成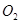 ,某同学取
,某同学取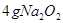 样品与过量水反应,待反应完全终止时,得
样品与过量水反应,待反应完全终止时,得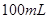 溶液X和
溶液X和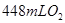 (已折算为标准状况),该同学推测样品中含有杂质或反应中生成
(已折算为标准状况),该同学推测样品中含有杂质或反应中生成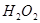 ,并进行实验研究。
,并进行实验研究。①取少量X于试管中,滴加
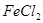 溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。
溶液,立即生成红褐色沉淀,则反应的离子方程式为________________________________________________________。②通过如上图所示整套实验装置测定
 样品的纯度,假设所含杂质不参加反应,取25
样品的纯度,假设所含杂质不参加反应,取25 ,滴入烧瓶内使其与过量
,滴入烧瓶内使其与过量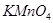 酸性溶液反应,最终生成
酸性溶液反应,最终生成 (已折算为标准状况),则此样品中
(已折算为标准状况),则此样品中 的质量分数是____________________________。
的质量分数是____________________________。 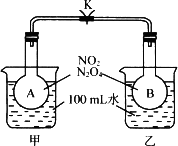
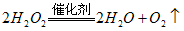 可制备氧气。
可制备氧气。  溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。 
 分解速率的影响。
分解速率的影响。  做该反应的催化剂,使用如下图所示装置的A部分制备
做该反应的催化剂,使用如下图所示装置的A部分制备 ,避免反应过于剧烈的操作是_____________________
,避免反应过于剧烈的操作是_____________________
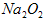 与水反应也可生成
与水反应也可生成 ,某同学取
,某同学取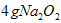 样品与过量水反应,待反应完全终止时,得
样品与过量水反应,待反应完全终止时,得 溶液X和
溶液X和 (已折算为标准状况),该同学推测样品中含有杂质或反应中生成
(已折算为标准状况),该同学推测样品中含有杂质或反应中生成 ,并进行实验研究。
,并进行实验研究。  溶液,立即生成红褐色沉淀,则反应的离子方程式为__________________________________________________。
溶液,立即生成红褐色沉淀,则反应的离子方程式为__________________________________________________。 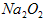 样品的纯度,假设所含杂质不参加反应,取
样品的纯度,假设所含杂质不参加反应,取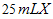 ,滴入烧瓶内使其与过量
,滴入烧瓶内使其与过量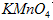 酸性溶液反应,最终生成
酸性溶液反应,最终生成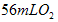 (已折算为标准状况),则此样品中
(已折算为标准状况),则此样品中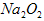 的质量分数是_____________________。
的质量分数是_____________________。