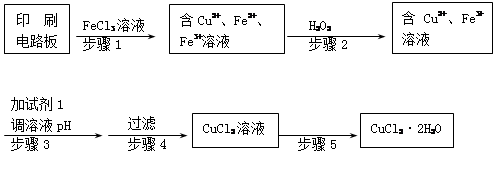题目内容
(16分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
(1)负;4 Al2Cl7—+3e?="Al+7" AlCl4—;H2
(2)3
(3)b、d;不能;Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+(或只写Fe+2Fe3+-3Fe2+)
解析试题分析:(1)钢制品为渡件,电镀时作阴极,连接电源的负极;电镀铝阴极应生成单质铝,所以阴极电极反应式为:4 Al2Cl7—+3e?="Al+7" AlCl4—;若改用AlCl3水溶液作电解液,H2O电离产生的H+放电生成H2。
(2)用NaOH溶液溶解钢制品表面的铝镀层的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑还原产物为H2,与转移电子的对应关系为:H2 ~ 2e?,n(H2)=1/2n(e?)=1/2×6mol=3mol。
(3)铝热反应需要用Mg燃烧提供反应条件,KClO3提供O2,所以b、d正确;H2SO4与Fe2O3反应可生成Fe3+,但铝热反应生成的Fe可将Fe3+还原为Fe2+,发生反应:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,加入KSCN,无明显现象。
考点:本题考查电化学原理、氧化还原反应原理、铝热反应、离子的检验。

在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu |
| B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ |
| D.残余固体是Fe,溶液中一定不含Cu2+ |
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: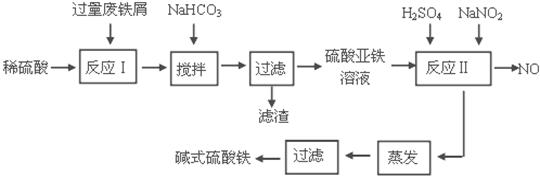
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:

则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
2013年1月26日15时整,中国国产大型军用运输机运-20成功降落。标志着运-20首飞圆满成功。请回答下列问题:
Ⅰ.运-20根据结构和性能要求不同,使用的材料也不同,你认为下列材料中用于运-20制造,合理的是 (填序号)。
| A.利用纯铝制造运-20发动机 |
| B.用镁铝合金制造运-20座椅 |
| C.用氧化铝制造运-20电器线路的导线 |
| D.用普通钢制造运-20灭火器的外壳 |
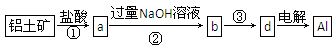
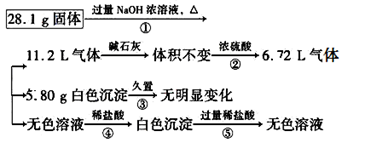
(1)①②中除加试剂外,还需要进行的操作是 。
(2)写出步骤②反应的化学方程式: 。
(3)③中需要通人过量的二氧化碳,写出该过程中含铝化合物发生反应的离子方程式: 。
(4)一种新型镁铝合金的化学式为Mg17Al12,科学家发现它具有储氢性能,是一种潜在的储氢材料,可在氩气保护下,将一定比例的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)在一定条件下能释放出氢气。
①制备镁铝合金(Mg17Al12)时通人氩气的目的是 。
②在5.0 mol·L-1盐酸中,混合物Y能完全释放出H2。1 mol Mg17A112完全吸氢后得到的混合物Y与上述盐酸完全反应,消耗盐酸的体积为 L。

 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu