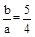题目内容
纯碱在工业上非常重要.(1)取一定量纯碱细小粉末置于烧杯中,加入一定量的水,可以得到颗粒较大的晶体A.烧杯温度升高,理由是
(2)从上述烧杯中得到干燥纯净的晶体A,实验程序为:
①蒸发结晶②放入干燥器③转移入过滤器中④用水洗涤2-3次⑤用乙醇洗涤⑥加热灼烧
(3)取纯净物13.92g晶体A,进行热重分析,直到质量不再改变,生成物质Z,具体数据如下:
| 物质 | 样品A | T1℃下得到物质X | T2℃下得到物质Y | 600℃时得到物质Z |
| 质量/g | 13.92 | 11.75 | 7.45 | 6.36 |
(2)将固体从液体中分离出来,可用过滤的方法,为得到干燥、纯净的固体,可用乙醇洗涤;
(3)根据反应的方程式,利用方程式计算.
故答案为:其化学原理为Na2CO3+nH2O=Na2CO3?nH2O;反应物总能量高于生成物总能量,故放出热量,导致温度升高;
(2)将固体从液体中分离出来,可用过滤的方法,为得到干燥、纯净的固体,可用乙醇洗涤,最后将固体放入干燥器中,故答案为:③⑤②;
(3)设A的化学式为Na2CO3?nH2O,加热到质量不再变化时为Na2CO3,
Na2CO3?nH2O→Na2CO3,
106+18n 106
13.92g 6.36g
| 106+18n |
| 106 |
| 13.92 |
| 6.36 |
解之得n=7,
则晶体为Na2CO3?7H2O,
故答案为:Na2CO3?7H2O.

纯碱在工业上非常重要。
(1)取一定量纯碱细小粉末置于烧杯中,加入一定量的水,可以得到颗粒较大的晶体A。烧杯温度升高,理由是 ;
(2)从上述烧杯中得到干燥纯净的晶体A,实验程序为: ;(填序号,可重复使用)
①蒸发结晶②放入干燥器③转移入过滤器中④用水洗涤2-3次⑤用乙醇洗涤⑥加热灼烧
(3)取纯净物13.92g晶体A,进行热重分析,直到质量不再改变,生成物质Z,具体数据如下:
| 物质 | 样品A | T1oC下得到物质X | T2oC下得到物质Y | 600oC时得到物质Z |
| 质量/g | 13.92 | 11.75 | 7.45 | 6.36 |
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
10℃ |
35.8 |
8.15 |
33.0 |
|
45℃ |
37.0 |
14.0 |
50.0 |
(1)117g食盐理论上可以制取纯碱 g;
(2)45℃反应完毕后,有晶体析出;溶液中剩余水 g,析出晶体的质量 g。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量共 克
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
|
b∕a的取值范围 |
溶质 |
溶质物质的量 |
|
|
|
|
|
|
—— |
—— |
|
|
|
|
|
|
|
|
纯碱在工业上非常重要。
(1)取一定量纯碱细小粉末置于烧杯中,加入一定量的水,可以得到颗粒较大的晶体A。烧杯温度升高,理由是 ;
(2)从上述烧杯中得到干燥纯净的晶体A,实验程序为: ;(填序号,可重复使用)
①蒸发结晶②放入干燥器③转移入过滤器中④用水洗涤2-3次⑤用乙醇洗涤⑥加热灼烧
(3)取纯净物13.92g晶体A,进行热重分析,直到质量不再改变,生成物质Z,具体数据如下:
|
物质 |
样品A |
T1oC下得到物质X |
T2oC下得到物质Y |
600oC时得到物质Z |
|
质量/g |
13.92 |
11.75 |
7.45 |
6.36 |
通过计算确定样品A的化学式。并写出计算过程。