题目内容
【题目】已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
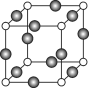
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。
【答案】(1)N>O>C;(2)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) ;
(3)C2H6,氮的氢化物(N2H4)分子间存在氢键;(4)sp2,4NA; ⑸Cu3N,6。
【解析】
试题分析:X是周期表中原子半径最小的元素,推出X为H,Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道的电子数相同,则Y为C,W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍,W的排布式为1s22s22p4,W为O,K位于ds区且原子的最外层电子数与H相同,即K为Cu,(1)同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,即N>O>C;(2)Cu属于29号元素,位于第四周期IB族元素,即电子排布式为:1s22s22p63s23p63d104s1(或[Ar] 3d104s1) ;(3)C、H构成18电子分子,则化学式为C2H6,它们属于分子晶体,沸点相差较大,是因为含有氢键的缘故;(4)C、H、O组成的化合物为酸性,且分子量为46,此物质为HCOOH,其中C有3个σ键,无孤电子对,杂化轨道=价层电子对数,即杂化类型为sp2,成键原子之间只能形成1个σ键,即1mol甲酸中含有4molσ键,个数为4NA;(5)电子层数越多,半径越大,大球是Cu,小球为O,Cu为棱上,根据均摊法,原子个数为12×1/4=3,N的个数为8×1/8=1,化学式为Cu3N,N周围最近的Cu的个数有6个,即配位数为6。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案