题目内容
将过量的铝粉与FeO?2Fe2O3粉末配制成铝热剂,并分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体15.68L(标准状况);另一份在高温下发生铝热反应,反应后的混合物与足量的盐酸反应,放出气体的体积(标准状况)可能为
- A.11.20 L
- B.15.68 L
- C.22.40 L
- D.13.36 L
D
分析:分成两等份.一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气,15.68L为氢气体积,根据氢气的体积计算出铝的物质的量.另一份在高温下恰好反应完全,实质为铝置换出铁,铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO?2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量.根据铁的物质的量计算铁与盐酸反应生成的氢气体积.依据化学方程式计算得到.
解答:一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成氢气15.68L,
氢气的物质的量为 =0.7mol.
=0.7mol.
若铝恰好和铁的氧化物反应,铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,
所以根据关系式3H2~~~~2Al~~~~3O~~~~Al2O3
3 2 3
0.7mol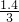 mol 0.7mol
mol 0.7mol
由于氧化物为FeO?2Fe2O3,根据氧原子守恒,所以氧化物FeO?2Fe2O3的为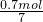 =0.1mol.
=0.1mol.
根据铁原子守恒,可知另一份生成的铁的物质的量为0.1mol×5=0.5mol.
根据Fe~H2可知,0.5molFe可生成氢气0.5mol,所以另一份生成的氢气的体积为0.5mol×22.4L/mol=11.20L.
若铝全部与盐酸生成气体物质的量=0.7mol,气体体积=0.7mol×22.4L/mol=15.68L,
因为题干中铝过量,所以生成气体体积在11.2L--15.68L间,所以D符合;
故选D.
点评:本题考查混合物的计算、铝的性质,难度较大,关键清楚反应过程.本解法在反应的基础上利用原子守恒,极值计算应用,简化计算步骤,注意守恒思想的灵活运用.
分析:分成两等份.一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气,15.68L为氢气体积,根据氢气的体积计算出铝的物质的量.另一份在高温下恰好反应完全,实质为铝置换出铁,铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO?2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量.根据铁的物质的量计算铁与盐酸反应生成的氢气体积.依据化学方程式计算得到.
解答:一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成氢气15.68L,
氢气的物质的量为
 =0.7mol.
=0.7mol.若铝恰好和铁的氧化物反应,铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,
所以根据关系式3H2~~~~2Al~~~~3O~~~~Al2O3
3 2 3
0.7mol
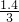 mol 0.7mol
mol 0.7mol由于氧化物为FeO?2Fe2O3,根据氧原子守恒,所以氧化物FeO?2Fe2O3的为
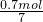 =0.1mol.
=0.1mol.根据铁原子守恒,可知另一份生成的铁的物质的量为0.1mol×5=0.5mol.
根据Fe~H2可知,0.5molFe可生成氢气0.5mol,所以另一份生成的氢气的体积为0.5mol×22.4L/mol=11.20L.
若铝全部与盐酸生成气体物质的量=0.7mol,气体体积=0.7mol×22.4L/mol=15.68L,
因为题干中铝过量,所以生成气体体积在11.2L--15.68L间,所以D符合;
故选D.
点评:本题考查混合物的计算、铝的性质,难度较大,关键清楚反应过程.本解法在反应的基础上利用原子守恒,极值计算应用,简化计算步骤,注意守恒思想的灵活运用.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目