题目内容
向50mL1mol/L的Al2(SO4)3溶液中加入100mLKOH溶液,充分反应得到3.9g沉淀,求KOH溶液的物质的量浓度。(原子量Al27 O16 S32 K39 H1 )
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
3.5mol/L
考查根据方程式进行的有关计算。
硫酸铝是0.05L×1mol/L=0.05mol,含有铝离子是0.1mol。
由于生成的氢氧化铝沉淀是3.9g÷78g/mol=0.05mol
这说明铝离子没有完全转化为氢氧化铝沉淀
如果加入的氢氧化钾不足,铝离子有剩余,则
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
6mol 2mol
0.15mol 0.05mol
所以氢氧化钾的浓度是0.15mol÷0.1L=1.5mol/L
如果氢氧化钾过量,过量的氢氧化钾将部分氢氧化铝溶解,则
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
1mol 6mol 2mol
0.05mol 0.3mol 0.1mol
Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
0.05mol 0.05mol
即实际消耗氢氧化钾是0.3mol+0.05mol=0.35mol
所以浓度所以氢氧化钾的浓度是0.35mol÷0.1L=3.5mol/L
硫酸铝是0.05L×1mol/L=0.05mol,含有铝离子是0.1mol。
由于生成的氢氧化铝沉淀是3.9g÷78g/mol=0.05mol
这说明铝离子没有完全转化为氢氧化铝沉淀
如果加入的氢氧化钾不足,铝离子有剩余,则
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
6mol 2mol
0.15mol 0.05mol
所以氢氧化钾的浓度是0.15mol÷0.1L=1.5mol/L
如果氢氧化钾过量,过量的氢氧化钾将部分氢氧化铝溶解,则
Al2(SO4)3+ 6KOH="2" Al(OH)3↓+3K2 SO4
1mol 6mol 2mol
0.05mol 0.3mol 0.1mol
Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
0.05mol 0.05mol
即实际消耗氢氧化钾是0.3mol+0.05mol=0.35mol
所以浓度所以氢氧化钾的浓度是0.35mol÷0.1L=3.5mol/L

练习册系列答案
相关题目
 H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是 、C1-
、C1-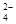 、Na+、Mg2+、NO
、Na+、Mg2+、NO HS-+H2O
HS-+H2O