题目内容
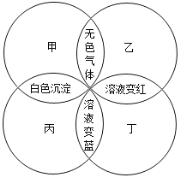
【题目】V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族,Z的单质可由其化合物发生反应制得,反应的离子方程式为
![]()
(1)上述反应中方框内的物质或离子为 (填化学式或离子符号)。
(2)Y、Z两种元素的简单离子的半径大小为 (用离子符号表示,半径用r表示)
(3)五种元素的最简单氢化物中,沸点最高的是 (填分子式),V、W、Y、Z四种元素的最高价含氧酸中有一种性质与其他三种不同,该酸的分子式为 。
(4)在催化剂作用下由VY2与Z2反应制得VZ4,该反应的化学方程式为VY2+Z2=VZ4+Y2Z2(未配平)。①写出上述反应的化学方程式: 。
②在Y2Z2分子中,Y与Z原子均满足8电子稳定结构,则Y2Z2的电子式为 。
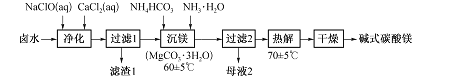
(5)化合物ZnFe2Xa可作为新型纳米材料,常温下可将工业废气中的氧化物分解而除去。
![]()
若1mol ZnFe2Xa与YX2反应可生成0.75 mol Y,则a= ;1 mol ZnFe2Xa可分解物质的量之比为3:2的WX2、WX的混合气体的体积V= L(标准状况下)。
(6)Q与X同主族,位于第四周期,其原子序数为________。
【答案】(1)Cl-(2)r(S2-)>r(Cl-)(3)H2O H2CO3(4)①CS2+3Cl2![]() CCl4+S2Cl2
CCl4+S2Cl2
②![]() (5)5/2 24 (6)34
(5)5/2 24 (6)34
【解析】试题分析:由题目所给信息可推断出:V为C元素,W为N元素,X为O元素,Y为S元素,Z为Cl元素。(1)在制取Z单质的反应中,Cl-与ClO3-发生归中反应生成Cl2,离子方程式为:5Cl-+ClO3-+ 6H+="3" Cl2+ 3H2O;(2)Y为S元素,Z为Cl元素,由于S2-和Cl-具有相同的核外电子排布,当核外电子排布相同时,核电荷数越大,半径越小,故半径:r(S2-)>r(Cl-);(3)由于H2O分子中有氢键,因此五种元素的最简单氢化物中,沸点最高的是H2O;C、N、S、Cl四种元素的最高价含氧酸中有一种性质与其他三种不同,该酸为H2CO3,原因是H2CO3为弱酸,而HNO3、H2SO4和HClO4为强酸;(4)①在催化剂作用下由CS2与Cl2反应制得CCl4,反应的化学方程式为:CS2+3Cl2![]() CCl4+S2Cl2;②在S2Cl2分子中,S与Cl原子均满足8电子稳定结构,则S2Cl2的电子式为:
CCl4+S2Cl2;②在S2Cl2分子中,S与Cl原子均满足8电子稳定结构,则S2Cl2的电子式为:![]() ;(5)若1mol ZnFe2Oa与SO2反应可生成0.75 mol S,S元素化合价由+4价降为0价,因此得电子的物质的量为
;(5)若1mol ZnFe2Oa与SO2反应可生成0.75 mol S,S元素化合价由+4价降为0价,因此得电子的物质的量为![]() ;在ZnFe2Oa中Fe元素化合价为+(a-1),ZnFe2O4中Fe元素的化合价为+3价,化合价升高,故失去电子的物质的量为:
;在ZnFe2Oa中Fe元素化合价为+(a-1),ZnFe2O4中Fe元素的化合价为+3价,化合价升高,故失去电子的物质的量为:![]() ,根据得失电子守恒可知,
,根据得失电子守恒可知,![]() ,故
,故![]() ;设NO2、NO的物质的量分别为3x、2x,由于Fe元素化合价升高,则氮元素化合价降低,即NO2、NO均被还原为N2,则根据得失电子守恒可知:
;设NO2、NO的物质的量分别为3x、2x,由于Fe元素化合价升高,则氮元素化合价降低,即NO2、NO均被还原为N2,则根据得失电子守恒可知:![]() ,解得:
,解得:![]() ,则标准状况下,混合气体的总体积
,则标准状况下,混合气体的总体积![]() (6)Q与O元素同主族,且Q位于第四周期,则Q为Se,原子序数为34。
(6)Q与O元素同主族,且Q位于第四周期,则Q为Se,原子序数为34。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案