题目内容
【题目】研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
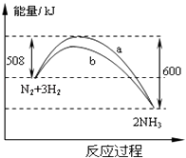
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示: 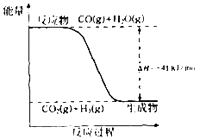
①反应的热化学方程式为 .
②已知:C(s)+H2O (g)═CO(g)+H2(g)△H=+131kJmoL﹣1
则C(s)+CO2(g)═2CO(g)△H= .
(2)化学反应可视为旧键断裂和新键形成的过程.:已知N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1;N﹣H键的键能是391.55kJ/mol..则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g)△H= .
H2(g)═NH3(g)△H= .
(3)在25℃、101Pa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为
【答案】
(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJ?mol﹣1;+172kJ/mol
(2)﹣46.2 KJ/moL
(3)CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ?mol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ?mol﹣1
【解析】解:(1)①图象分析反应是放热反应,焓变为﹣41KJ/mol,标注物质狙击状态和对应反应焓变得到热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJmol﹣1 , 所以答案是:CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJmol﹣1;②(1)CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41kJmol﹣1;(2)C(s)+H2O(g)═CO(g)+H2(g)△H=+131kJmol﹣1
依据盖斯定律(2)﹣(1)得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,
所以答案是:+172kJ/mol;(2)N≡N键的键能是948.9kJmol﹣1 , H﹣H键的键能是436.0kJmol﹣1; N﹣H键的键能是391.55kJmol﹣1 . 则 ![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g);
H2(g)═NH3(g);
△H=反应物键能总和﹣生成物键能总和= ![]() ×948.9kJmol﹣1 +
×948.9kJmol﹣1 + ![]() ×436.0kJmol﹣1 ﹣3×391.55kJmol﹣1=﹣46.2KJ/mol,
×436.0kJmol﹣1 ﹣3×391.55kJmol﹣1=﹣46.2KJ/mol,
所以答案是:﹣46.2 kj/mol;(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJmol﹣1 ,
O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJmol﹣1 ,
所以答案是:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJmol﹣1 .
O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJmol﹣1 .

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】分类是化学学习和研究的常用手段,下列关于物质分类的正确组合是( )
酸 | 碱 | 盐 | 氧化物 | |
A | HNO3 | NaOH | NaCl | H2O |
B | HCl | CaO | Na2CO3 | NH3 |
C | H2SO4 | Ba(OH)2 | CO2 | Na2O2 |
D | H3PO4 | KOH | Al(OH)3 | BaSO4 |
A. AB. BC. CD. D