题目内容
 (08龙岩一中三模)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(
(08龙岩一中三模)(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(![]() )和
)和![]() 反应生成
反应生成![]() 过程中能量变化示意图,请写出白磷(
过程中能量变化示意图,请写出白磷(![]() )和
)和![]() 反应生成
反应生成![]() 的热化学方程式:
的热化学方程式:
_____________ ______________(△H用含![]() 和
和![]() 的代数式表示,其中E1、E2均大于0)。
的代数式表示,其中E1、E2均大于0)。
(2)常温下取0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的![]() ________0.2mol/L HCl溶液中由水电离出
________0.2mol/L HCl溶液中由水电离出![]() ;(填“>”、“<”或“=”)
;(填“>”、“<”或“=”)
②求出混合物中下列算式的精确计算结果。
![]() =________mol/L,
=________mol/L,![]() =________mol/L。
=________mol/L。
③如果常温下取0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”或“=”)
答案:(1)![]() ;△H
;△H![]() ;
;
(2)①> ②![]() ;
;![]() ③<
③<

(08龙岩一中三模)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》可知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 _ ,反应的离子方程式为 _。
(3) 实验室溶解该熔融物,下列试剂中最好的是_ _ (填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
 Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 _。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_
;
上述现象说明溶液中 、 、 结合OH-的能力比 强(填离子符号)。
(3) B与A的差值为 mol。
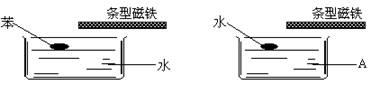
(08龙岩一中三模)如下图,分别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为()
 |
A.煤油 B.酒精 C.苯 D.四氯化碳