题目内容
尿素[CO(NH2)2]是首个由无机物人工合成的有机物,工业上尿素是用CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2 CO(NH3)2+H2O,当氨碳比
CO(NH3)2+H2O,当氨碳比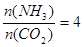 ,CO2的转化率随时间的变化关系如右图所示,下列说法错误的是
,CO2的转化率随时间的变化关系如右图所示,下列说法错误的是
| A.该反应在60min时达到平衡状态 |
| B.NH3的平衡转化率为30% |
| C.增加氨碳比可进一步提高CO2的平衡转化率 |
| D.A点的逆反应速率v逆(CO2)大于B点的正反应速率V正(CO2) |
D
解析试题分析:A、根据图像可知,反应进行到60min时CO2的转化率不再发生变化,说明反应达到平衡状态,A正确;B、设CO2的起始量是1mol,则氨气是4mol,平衡时消耗CO2是0.6mol,则根据方程式可知,消耗氨气的物质的量是1.2mol,所以氨气的转化率是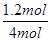 ×100%=30%,B正确;C、增加氨碳比,相当于增加氨气的物质的量浓度,平衡向正反应方向移动,因此可进一步提高CO2的平衡转化率,C正确;D、A点还没有达到平衡状态,此时正反应速率大于逆反应速率,所以A点的逆反应速率v逆(CO2)小于B点的正反应速率V正(CO2),D不正确,答案选D。
×100%=30%,B正确;C、增加氨碳比,相当于增加氨气的物质的量浓度,平衡向正反应方向移动,因此可进一步提高CO2的平衡转化率,C正确;D、A点还没有达到平衡状态,此时正反应速率大于逆反应速率,所以A点的逆反应速率v逆(CO2)小于B点的正反应速率V正(CO2),D不正确,答案选D。
考点:考查可逆反应速率的有关计算、外界条件对平衡状态的影响等

 阅读快车系列答案
阅读快车系列答案700℃时,在容积为2 L的密闭容器中发生反应CO(g) + H2O(g) CO2(g) + H2(g),部分数据见下表(表中t2>t1):
CO2(g) + H2(g),部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | | | |
| t2 | | 0.20 | | |
A.反应在t1 min内的反应速率为v(H2)=
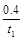 mol·L-1·min-1
mol·L-1·min-1B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)="0.40" mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
对于可逆反应mA(g)+nB(g) pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ-t图象如下图。则如下关系正确的为
pC(g)+gD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到两种υ-t图象如下图。则如下关系正确的为
①a1=a2;②a1<a2;③b1=b2;④b1<b2;⑤t1>t2;⑥t1=t2;⑦两图中阴影部分面积相等;⑧右图阴影部分面积更大
| A.②④⑤⑦ | B.②④⑥⑧ | C.②③⑤⑦ | D.②③⑥⑤ |
在一密闭恒容容器中发生如下反应:aX(g)+bY(g) cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
| A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大 |
| B.若通入稀有气体平衡不移动,则a+b=c |
| C.若加入催化剂,反应速率改变,但平衡不移动 |
| D.若增加X的量,平衡正向移动,X的转化率增大 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
已知反应mX(g)+nY(g) qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
qZ(g)+pW(s)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是
| A.通入氦气使密闭容器中压强增大,平衡向正反应方向移动 |
| B.增加X的物质的量,混合气体的密度减小 |
| C.降低温度,混合气体的平均相对分子质量增大 |
| D.X的正反应速率是Y的逆反应速率的m/n倍 |
有关下列图像的说法正确的是
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.根据图②判断,物质A反应生成物质C的△H>0 |
| C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化 |
| D.开关K置于A或B处均可减缓铁的腐蚀 |
在容积均为500 mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入l molN2和2.5 molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2(g)+3H2(g)2NH3(g) H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是
H<O。实验测得反应均进行到t min时N2的体积分数如图所示。下列说法正确的是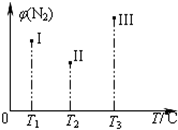
| A.当z,v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B.在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C.在t min时,一定没有达化学平衡状态的是I |
| D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
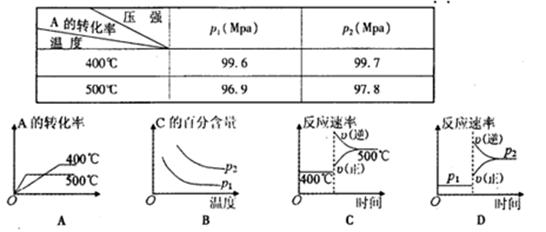
 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是