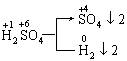题目内容
用过量的锌与一定量的浓硫酸反应,在反应过程中,除生成SO2气体外,还会有H2生成。(1)产生H2的原因是___________________________________________________________
_____________________________________________________________________________。
(2)如何检验反应过程中生成了SO2和H2?
答:
_______________________________________________________________________________
_______________________________________________________________________________
_____________________________________________________________________________。
(3)经完全反应后,测定产生的混合气体在标准状况下为22.4L,则反应消耗锌的质量是______________。
答案:
解析:
解析:
| (1)随着反应的进行,H2SO4的物质的量减少且因有H2O生成,导致硫酸的浓度变稀。而锌与稀H2SO4反应产生H2。
(2)将产生的混合气体依次通过品红溶液(红色褪去)、NaOH溶液(吸收SO2)后,用排水法收集一小试管H2,做爆鸣实验即可检验。 (3)产生1mol混合气体(SO2+H2),
|

练习册系列答案
相关题目