题目内容
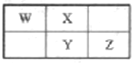
【题目】次氯酸钠(NaClO)是漂白液的主要成分,次氯酸钠溶液可用于消毒、杀菌及水处理。一种生产次氯酸钠的工艺如图所示。
-
(1)Cl 元素位于元素周期表第______周期___族。
(2)写出NaOH的电子式:__________。
(3)写出反应②的化学方程式:_______________。该反应中每生成1mol NaClO时,转移______mol 电子。
(4)“84”消毒液( 主要成分为NaClO)和洁厕灵( 主要成分为浓盐酸)不能混在一起使用,原因是_____________________(用离子方程式表示)。
【答案】 三 ⅦA ![]() Cl2+2NaOH=NaClO+NaCl+H2O 1 ClO-+Cl-+2H+=Cl2↑+H2O
Cl2+2NaOH=NaClO+NaCl+H2O 1 ClO-+Cl-+2H+=Cl2↑+H2O
【解析】试题分析:本题以生产NaClO的工艺为载体,考查元素在周期表中的位置,电子式的书写,氧化还原反应方程式的书写和计算。
(1)Cl的原子序数为17,Cl的原子结构示意图为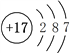 ,Cl元素在元素周期表中处于第三周期VIIA族。
,Cl元素在元素周期表中处于第三周期VIIA族。
(2)NaOH的电子式为![]() 。
。
(3)反应②为Cl2与NaOH反应生成NaClO、NaCl和H2O,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。在该反应中Cl元素的化合价部分由0价升至NaClO中的+1价,部分由0价降至NaCl中的-1价,1molCl2参与反应生成1molNaClO和1molNaCl,转移1mol电子。
(4)NaClO和浓盐酸混合发生归中反应生成Cl2,反应的化学方程式为:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目