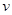题目内容
一定条件下,下列不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深 |
| C.实验室用排饱和NaHCO3溶液的方法收集CO2气体 |
| D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀 |
A.工业生产硫酸的过程中,存在2SO2+O2 2SO3,使用过量的氧气,平衡向正反应方向移动,故A不选;
2SO3,使用过量的氧气,平衡向正反应方向移动,故A不选;
B.平衡体系加压,平衡不移动,但浓度增大,颜色加深,不能用勒夏特列原理解释,故B选;
C.溶于水发生CO2+H2O?H2CO3?H++HCO3-,加入饱和NaHCO3溶液,HCO3-浓度增大,抑制CO2的溶解,可用勒夏特列原理解释,故C不选;
D.氯水中存在Cl2+H2O?H++Cl-+HClO,滴加硝酸银溶液,发生Ag++Cl-=AgCl↓溶液颜色变浅,产生白色沉淀,能用勒夏特列原理解释,故D不选;
故选B.
 2SO3,使用过量的氧气,平衡向正反应方向移动,故A不选;
2SO3,使用过量的氧气,平衡向正反应方向移动,故A不选;B.平衡体系加压,平衡不移动,但浓度增大,颜色加深,不能用勒夏特列原理解释,故B选;
C.溶于水发生CO2+H2O?H2CO3?H++HCO3-,加入饱和NaHCO3溶液,HCO3-浓度增大,抑制CO2的溶解,可用勒夏特列原理解释,故C不选;
D.氯水中存在Cl2+H2O?H++Cl-+HClO,滴加硝酸银溶液,发生Ag++Cl-=AgCl↓溶液颜色变浅,产生白色沉淀,能用勒夏特列原理解释,故D不选;
故选B.

练习册系列答案
相关题目
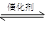 2CO2+N2
2CO2+N2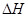 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。 2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大
2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大