题目内容
12.要使在容积恒定的密闭容器中进行的可逆反应2A(气)+B(固)═2C(气),△H<0的正反应速率显著加快,可采用的措施是(不考虑固、气态间的接触面积)( )| A. | 降温 | B. | 加入B | ||
| C. | 增大体积使压强减小 | D. | 加入A |
分析 对于反应2A(气)+B(固)═2C(气)来说,增大浓度、温度、压强或加入催化剂都可增大反应速率,注意B为固体的特点,以此解答.
解答 解:A.降低温度,反应速率减小,故A错误;
B.B为固体,加入B,反应速率不变,故B错误;
C.增大体积使压强减小,气体浓度降低,反应速率减小,故C错误;
D.加入A,则气体浓度增大,反应速率增大,故D正确.
故选D.
点评 本题考查化学反应速率的影响,侧重于学生的分析能力的考查,为高考常见题型,把握B为固体的特点,为解答该题的关键,难度不大,答题时注意审题,把握题给信息.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.下列物质中,在O3和Zn/H2O的作用下能生成 的是( )
的是( )
 的是( )
的是( )| A. | CH3-CH═CH-CH3 | B. | CH2═CH2 | ||
| C. | CH2═CCH3CH3 | D. | 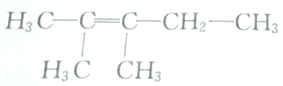 |
3.将40g NaOH溶于水中,配制成1L溶液,则该溶液的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
20.NH3和NO2在催化剂作用下反应:8NH3+6NO2═7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
7.实验室欲配制若干体积的1.0mol/L Na2CO3溶液,正确的方法是(假设其余各步操作正确无误)( )
| A. | 将10.6g Na2CO3溶于100mL水中 | |
| B. | 将57.2g Na2CO3•10H2O溶于少量水中,再用水稀释至200mL | |
| C. | 将20 mL 5.0mol/L Na2CO3溶液用水稀释至100mL | |
| D. | 将21.2gNa2CO3•10H2O溶于200mL水中 |
17.在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)?C(g)+D(g) 已达平衡标志的是( )
| A. | 混合气体的密度 | B. | B物质的相对分子质量 | ||
| C. | 混合气体的压强 | D. | 气体的总物质的量 |
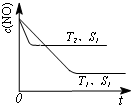 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: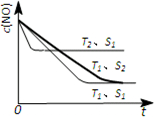 .
.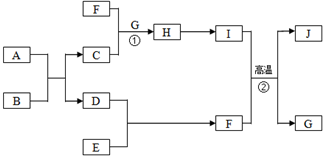 有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题:
有关物质的转化关系如图所示(部分物质与条件已略去).A是常见的金属单质,B是常见的强酸,E是空气中含量最多的单质,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g•mol-1).请回答下列问题: .
.