题目内容
有A、B、C、D、E、F六瓶未知溶液。它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH。为了鉴别,各取少许溶液进行两两混合试验,结果如右表。表中“↓”表示有沉淀或生成微溶化合物,“↑”表示有气体生成,“—”表示观察不到明显的现象变化。由此可判断:
A是____B是____C是____
D是____E是____F是____
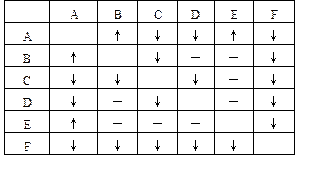
A是____B是____C是____
D是____E是____F是____
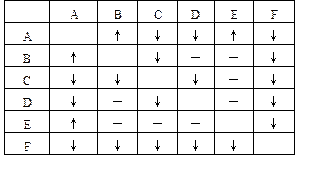
A是(NH4)2CO3 B是NaOH C是MgSO4 D是BaCl2 E是HBr F是AgNO3
先分析MgSO4与其余五种化合物反应时应观察到的现象:
MgSO4+BaCl2=MgCl2+BaSO4↓ 有沉淀生成
MgSO4+(NH4)2CO3=(NH4)2SO4+MgCO3↓ 有沉淀生成
MgSO4+2AgNO3=Ag2SO4↓+Mg(NO3)2 有沉淀生成
MgSO4+HBr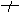 无明显变化
无明显变化
MgSO4+ 2NaOH=Mg(OH)2↓+Na2SO4 有沉淀生成
结果表明MgSO4与其他五种化合物的溶液反应时,应有四种发生沉淀,另一种无明显变化,这与表中C的</PGN0083B.TXT/PGN>情况完全一样,而不同于其他任何一种,故可判定C为MgSO4。再分析BaCl2与其余五种化合物溶液反应时应观察到的现象:
BaCl2+MgSO4=BaSO4↓+MgCl2 有沉淀生成
BaCl2+(NH4)2CO3=BaCO3↓+2NH4Cl 有沉淀生成
BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2 有沉淀生成
BaCl2+2HBr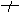 无明显变化
无明显变化
BaCl2+2NaOH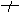 无明显变化
无明显变化
结果是有三种生成沉淀,两种无变化,和D与其他五种溶液反应所得的现象一致,而与其他均不同,故D为BaCl2。
用类似的方法可以判定A为(NH4)2CO3,F为AgNO3,E为HBr,B为NaOH。
MgSO4+BaCl2=MgCl2+BaSO4↓ 有沉淀生成
MgSO4+(NH4)2CO3=(NH4)2SO4+MgCO3↓ 有沉淀生成
MgSO4+2AgNO3=Ag2SO4↓+Mg(NO3)2 有沉淀生成
MgSO4+HBr
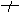 无明显变化
无明显变化MgSO4+ 2NaOH=Mg(OH)2↓+Na2SO4 有沉淀生成
结果表明MgSO4与其他五种化合物的溶液反应时,应有四种发生沉淀,另一种无明显变化,这与表中C的</PGN0083B.TXT/PGN>情况完全一样,而不同于其他任何一种,故可判定C为MgSO4。再分析BaCl2与其余五种化合物溶液反应时应观察到的现象:
BaCl2+MgSO4=BaSO4↓+MgCl2 有沉淀生成
BaCl2+(NH4)2CO3=BaCO3↓+2NH4Cl 有沉淀生成
BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2 有沉淀生成
BaCl2+2HBr
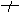 无明显变化
无明显变化BaCl2+2NaOH
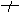 无明显变化
无明显变化结果是有三种生成沉淀,两种无变化,和D与其他五种溶液反应所得的现象一致,而与其他均不同,故D为BaCl2。
用类似的方法可以判定A为(NH4)2CO3,F为AgNO3,E为HBr,B为NaOH。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目