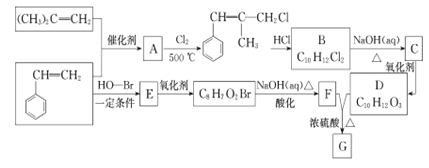
题目内容
【题目】室温下,用相同物质的量浓度的HC1溶液,分别滴定物质的量浓度均为0.1mol·L-1。的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是
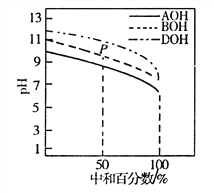
A. 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大
B. 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,三种溶液中c(C1-)相等
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
【答案】D
【解析】A、酸溶液和碱溶液都抑制水的电离,盐类水解促进水的电离,随着盐酸溶液的滴入,溶液由碱溶液变为盐溶液再变为酸溶液,水电离出的c(H+)先增大后减小,错误;B、滴定至P点时溶质为等物质的最的BOH和BCl,溶液呈碱性,BOH的电离为主,但电离程度较小,因此c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),错误;C、pH=7时,三种溶液中阳离子的水解程度不同,加入的盐酸的体积不同,三种离子浓度分别与氯离子浓度相等,但三种溶液中氯离子浓度不等,错误;D、当中和百分数达100%时,将三种溶液混合后的质子守恒为:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-),正确。答案选D。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目