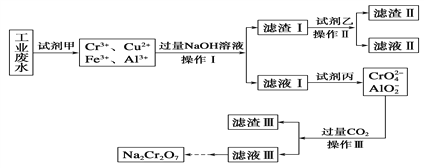
题目内容
【题目】美国医学家证实了3价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的外围电子排布图为_______________________________ 。
(2)SO2分子的空间构型为__________,是__________ 分子(填“极性”或“非极性”);SO32-离子中心原子的杂化方式为__________。
(3)SCN的电子式为_________________,它的等电子体中属于分子的有___________。
(4)四种分子:①CH4、②SO3、③H2O、④NH3,键角由大到小的排列顺序是________(填序号)。
(5)NH3分子可以与H+ 结合生成NH4+,这个过程发生改变的是_____
a. 微粒的空间构型 b. N原子的杂化类型 c. H-N-H的键角 d. 微粒的电子数
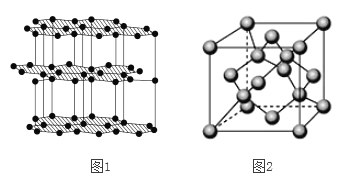
(6)由碳元素形成的某种单质的片状和层状结构如图1所示,由碳元素形成的某种晶体的晶胞结构如图2所示,试回答:
①在图1中,碳原子所形成的六元环数、C原子数、C-C键数之比为_____________;
②在图2中,已知阿伏伽德罗常数为NA,晶体密度为ρ g/cm3,则该晶体的棱长为
________________pm(只列式,不计算)。
【答案】 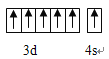 V形 极性分子 SP3
V形 极性分子 SP3 ![]() N2O或CO2或CS2等 ②>①>④>③ a、c 1:2:3
N2O或CO2或CS2等 ②>①>④>③ a、c 1:2:3 ![]()
【解析】(1)考查价电子和电子排布图的书写,Cr位于第四周期VIB族,其价电子为最外层电子和次外层d能级上的电子,因此电子排布图为 ;(2)本题考查空间构型、杂化类型,SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,杂化类型为sp2,空间构型为V型,属于极性分子,SO32-中心原子是S,含有3个σ键,孤电子对数为(6+2-2×3)/2=1,杂化类型为sp3;(3)本题考查电子式的书写和等电子体的判断,SCN-的电子式,要求每个原子达到8电子稳定结构,因此SCN-的电子式为
;(2)本题考查空间构型、杂化类型,SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,杂化类型为sp2,空间构型为V型,属于极性分子,SO32-中心原子是S,含有3个σ键,孤电子对数为(6+2-2×3)/2=1,杂化类型为sp3;(3)本题考查电子式的书写和等电子体的判断,SCN-的电子式,要求每个原子达到8电子稳定结构,因此SCN-的电子式为![]() ,原子总数相等,价电子总数相等的微粒互为等电子体,因此与SCN-互为等电子体的分子是N2O、CO2、CS2等;(4)本题考查影响键角的因素,①CH4没有孤电子对,属于正四面体结构,键角是10928’,②SO3没有孤电子对,属于平面三角形,键角是120 ,③H2O中心原子O有两个孤电子对,④NH3中心原子有1个孤电子对,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间的斥力,因此键角的大小顺序是②>①>④>③;(5)本题考查杂化类型、键角、电子数、空间构型,a、NH3的空间构型为三角锥形,NH4+空间构型为正四面体,空间构型发生改变,故a正确;b、NH4+、NH3杂化类型都为sp3,故b错误;c、空间构型发生改变,则键角发生改变,故c正确;d、NH4+、NH3电子数都是10,故d错误;(6)本题考查晶胞的结构和晶胞的计算,①石墨中环上的碳原子被3个平面正六边形共面,因此一个环真正含有碳原子个数为6×1/3=2,C-C被2个正六边形共有,因此真正属于正六边形的C-C个数为6×1/2=3,因此六元环:C原子个数:C-C个数比为1:2:3;②碳原子位于顶点、面心、内部,个数为8×1/8+6×1/2+4=8,因此晶胞的质量为8×12/NAg,晶胞的体积为(a×10-10)cm3,根据密度的定义,ρ=96/[NA×(a×10-10)],因此
,原子总数相等,价电子总数相等的微粒互为等电子体,因此与SCN-互为等电子体的分子是N2O、CO2、CS2等;(4)本题考查影响键角的因素,①CH4没有孤电子对,属于正四面体结构,键角是10928’,②SO3没有孤电子对,属于平面三角形,键角是120 ,③H2O中心原子O有两个孤电子对,④NH3中心原子有1个孤电子对,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间的斥力,因此键角的大小顺序是②>①>④>③;(5)本题考查杂化类型、键角、电子数、空间构型,a、NH3的空间构型为三角锥形,NH4+空间构型为正四面体,空间构型发生改变,故a正确;b、NH4+、NH3杂化类型都为sp3,故b错误;c、空间构型发生改变,则键角发生改变,故c正确;d、NH4+、NH3电子数都是10,故d错误;(6)本题考查晶胞的结构和晶胞的计算,①石墨中环上的碳原子被3个平面正六边形共面,因此一个环真正含有碳原子个数为6×1/3=2,C-C被2个正六边形共有,因此真正属于正六边形的C-C个数为6×1/2=3,因此六元环:C原子个数:C-C个数比为1:2:3;②碳原子位于顶点、面心、内部,个数为8×1/8+6×1/2+4=8,因此晶胞的质量为8×12/NAg,晶胞的体积为(a×10-10)cm3,根据密度的定义,ρ=96/[NA×(a×10-10)],因此![]() 。
。