题目内容
要证明某溶液中不含Fe3+而可能含有Fe2+.进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
分析:先根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在.
解答:解:因为KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,
再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,即③①,
故选A.
再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,即③①,
故选A.
点评:本题考查离子的检验,注意滴加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe3+.

练习册系列答案
相关题目
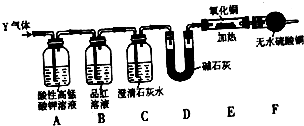
 某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.