题目内容
下列说法不正确的是
- A.Na2CO3比NaHCO3热稳定性好
- B.Na2CO3比NaHCO3易溶于水
- C.相同条件下,Na2CO3溶液的碱性强于同物质的量浓度的NaHCO3溶液
- D.用质量相同的苏打和小苏打与足量的盐酸反应可得到相同质量的CO2
D
分析:A、根据Na2CO3与NaHCO3热稳定性不同;
B、根据Na2CO3与NaHCO3的溶解度不同;
C、根据CO32-与HCO3-的水解程度不同;
D、用质量相同的苏打和小苏打与足量的盐酸反应产生的CO2不同;
解答:A、因Na2CO3热稳定性比NaHCO3强,故A错误;
B、因Na2CO3比NaHCO3的溶解度大,即Na2CO3比NaHCO3易溶于水,故B错误;
C、因CO32-比HCO3-的水解程度大,所以相同条件下,Na2CO3溶液的碱性强于同物质的量浓度的NaHCO3溶液,故C错误;
D、因质量相同的苏打和小苏打与足量的盐酸,小苏打反应产生的CO2多,故D正确;
故选:D.
点评:盐酸首先与碳酸钠反应生成碳酸氢钠,没有二氧化碳产生,然后与碳酸氢钠反应,生成二氧化碳.
分析:A、根据Na2CO3与NaHCO3热稳定性不同;
B、根据Na2CO3与NaHCO3的溶解度不同;
C、根据CO32-与HCO3-的水解程度不同;
D、用质量相同的苏打和小苏打与足量的盐酸反应产生的CO2不同;
解答:A、因Na2CO3热稳定性比NaHCO3强,故A错误;
B、因Na2CO3比NaHCO3的溶解度大,即Na2CO3比NaHCO3易溶于水,故B错误;
C、因CO32-比HCO3-的水解程度大,所以相同条件下,Na2CO3溶液的碱性强于同物质的量浓度的NaHCO3溶液,故C错误;
D、因质量相同的苏打和小苏打与足量的盐酸,小苏打反应产生的CO2多,故D正确;
故选:D.
点评:盐酸首先与碳酸钠反应生成碳酸氢钠,没有二氧化碳产生,然后与碳酸氢钠反应,生成二氧化碳.

练习册系列答案
相关题目
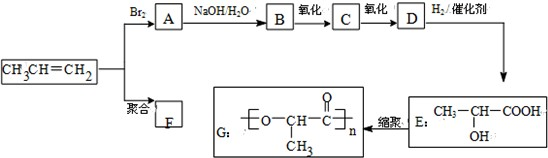

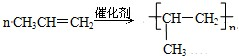

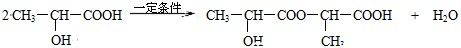


 2SO3(g)。下列说法不正确的是
2SO3(g)。下列说法不正确的是