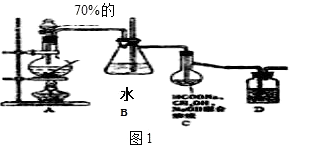
题目内容
【题目】室温下,在0.2molL﹣1 Al2(SO4)3溶液中,逐滴加入1.0molL﹣1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( ) 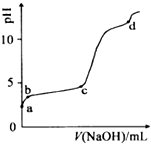
A.a点溶液呈酸性的原因是Al3+水解,离子方程为:Al3++3OH﹣Al(OH)3
B.c点铝元素主要以Al(OH)3的形式存在
C.a﹣b段,溶液pH增大,Al3+浓度不变
D.d点Al(OH)3沉淀开始溶解
【答案】B
【解析】解:室温下,往0.2mol/LAl2 ( SO4)3溶液中逐滴加入1.0mol/L NaOH溶液,硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2OAl(OH)3+3H+;a﹣b段,加入NaOH溶液,消耗氢离子,发生反应:H++OH﹣═H2O,b﹣c段溶液的pH变化不大,主要发生反应:Al3++3OH﹣═Al(OH)3↓,则加入的OH﹣主要用于生成Al(OH)3沉淀;c﹣d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2 , 碱性较强,
A.硫酸铝为强酸弱碱盐,铝离子水解导致溶液显酸性,水解离子反应为Al3++3H2OAl(OH)3+3H+ , 故A错误;
B.b﹣c段溶液的pH变化不大,主要发生反应:Al3++3OH﹣═Al(OH)3↓,则加入的OH﹣主要用于生成Al(OH)3沉淀;c﹣d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2 , 所以c点铝元素主要以Al(OH)3的形式存在,故B正确;
C.a﹣b段,发生H++OH﹣═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故C错误;
D.c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2 , 碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选B.