题目内容
欲配制2.0mol/LNaCl溶液100mL,下列操作方法中正确的是
- A.称取5.85gNaCl,将其溶于50mL水中
- B.称取11.7gNaCl,将其溶于100mL水中
- C.称取11.7gNaCl,溶于适量水后,再加水稀释到100mL
- D.称取称取11.7gNaCl,溶于88.3mL水中
C
分析:配制2.0mol/LNaCl溶液100mL,需要算氯化钠的物质的量为0.1L×2.0mol/L=0.2mol,需要氯化钠的质量为0.2mol×58.5g/mol=11.7g,称量11.7g氯化钠溶于水配制成100mL溶液即可.
解答:A.需要配置溶液的体积是100mL,故A错误;
B.称取11.7gNaCl,将其溶于100mL水中,溶液的体积大于100mL,则其物质的量浓度小于0.2mol/L,故B错误;
C.根据C= =
=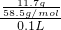 =0.2mol/L,所以称取11.7gNaCl,溶于适量水后,再加水稀释到100mL,溶液的物质的量浓度是0.2mol/L,故C正确;
=0.2mol/L,所以称取11.7gNaCl,溶于适量水后,再加水稀释到100mL,溶液的物质的量浓度是0.2mol/L,故C正确;
D.溶质的物质的量是0.2mol,称取11.7gNaCl,溶于88.3mL水中,溶液的体积小于100mL,所以配制溶液的物质的量浓度大于0.2mol/L,故D错误;
故选C.
点评:本题考查一定物质的量浓度溶液的配制,注意C= 中V指溶液的体积而不是溶剂的体积,为易错点.
中V指溶液的体积而不是溶剂的体积,为易错点.
分析:配制2.0mol/LNaCl溶液100mL,需要算氯化钠的物质的量为0.1L×2.0mol/L=0.2mol,需要氯化钠的质量为0.2mol×58.5g/mol=11.7g,称量11.7g氯化钠溶于水配制成100mL溶液即可.
解答:A.需要配置溶液的体积是100mL,故A错误;
B.称取11.7gNaCl,将其溶于100mL水中,溶液的体积大于100mL,则其物质的量浓度小于0.2mol/L,故B错误;
C.根据C=
 =
=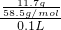 =0.2mol/L,所以称取11.7gNaCl,溶于适量水后,再加水稀释到100mL,溶液的物质的量浓度是0.2mol/L,故C正确;
=0.2mol/L,所以称取11.7gNaCl,溶于适量水后,再加水稀释到100mL,溶液的物质的量浓度是0.2mol/L,故C正确;D.溶质的物质的量是0.2mol,称取11.7gNaCl,溶于88.3mL水中,溶液的体积小于100mL,所以配制溶液的物质的量浓度大于0.2mol/L,故D错误;
故选C.
点评:本题考查一定物质的量浓度溶液的配制,注意C=
 中V指溶液的体积而不是溶剂的体积,为易错点.
中V指溶液的体积而不是溶剂的体积,为易错点. 
练习册系列答案
相关题目