��Ŀ����
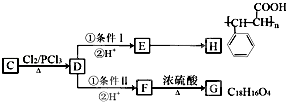
����Ŀ���Ժ�Fe2O3��FeO��SiO2��Al2O3�Ļ����Ϊԭ�ϣ���������Ʊ����죨Fe2O3���ķ��������ֲ�������ȥ�� [����1]![]()
[����2]![]()
��1����ҺA�������������� ��
��2������˫��ˮ�������� ��
��3������C�ijɷ������ѧʽ����
��4���Լ�x����ѡ��������ţ��� a��NaOH��Һ b����ˮ c��������̼ d��ϡH2SO4
��5�����Լ�x��ȡԭ�Ϸ��������ӷ���ʽ���� ��
���𰸡�
��1��Fe3+��Fe2+��Al3+����H+��
��2����Fe2+ȫ��ת��ΪFe3+
��3��Fe��OH��3
��4��a
��5��SiO2+2OH��=SiO32��+H2O�� Al2O3+2OH��=2AlO2��+H2O
���������⣺��1����Fe2O3��FeO��SiO2��Al2O3�Ļ����Ϊԭ�ϼ������ܽ⣬��ҺA��������������Fe3+��Fe2+��Al3+����H+����
���Դ��ǣ�Fe3+��Fe2+��Al3+����H+������2����ҺA��H2O2������������Fe2+ ȫ��ת��ΪFe3+��
���Դ��ǣ���Fe2+ ȫ��ת��ΪFe3+����3������������Fe3+��Al3+����Һ�м����������������ƣ���Ӧ����Fe��OH��3��NaAlO2������C�ijɷ���Fe��OH��3��
���Դ��ǣ�Fe��OH��3����4���Լ�x����ѡ���������ƣ�
���Դ��ǣ�a����5�����Լ�x���������ƣ���ȡԭ�Ϸ��������ӷ���ʽ�ǣ�SiO2+2OH��=SiO32��+H2O��Al2O3+2OH��=2AlO2��+H2O��
���Դ��ǣ�SiO2+2OH��=SiO32��+H2O��Al2O3+2OH��=2AlO2��+H2O��

����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�� | Ԫ�����ʻ�ԭ�ӵĽṹ |
T | 2p����ܼ���������s�ܼ���������1�� |
X | L��p�ܼ���������s�ܼ���������2�� |
Y | ��������Ԫ�صļ������а뾶��С |
Z | L����3��δ�ɶԵ��� |
��1��д��Ԫ��X�����ӽṹʾ��ͼ�� �� д��Ԫ��Z�ļ���̬�⻯��ĵ���ʽ��
��2��д��Ԫ��Y������������Ӧ��ˮ������KOH��Ӧ�Ļ�ѧ����ʽ�� ��
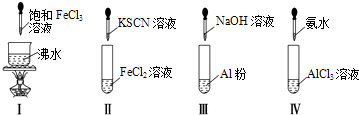
��3��T��Y��Z����Ԫ�صĵ����л�ѧ�������Բ�ͬ���������ʵ�������Ԫ�ط��ţ���ͬ����Ԫ��T���Ȼ�����ȣ��ǽ����Խ�ǿ���� �� ���б�������֤����һ��ʵ����������ĸ����
a����������������ɫ��T���ʵ���ɫ��
b��T�ĵ���ͨ���Ȼ���ˮ��Һ�в����û�����
c������T�γɻ������У���Ԫ�س����ۣ�