题目内容
 (2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.
(2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.(1)写出元素F在周期表中的位置
第3周期第IVA族
第3周期第IVA族
.(2)由元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,其电子式为
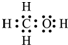
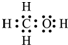
(3)已知这样两反应 G(s)+C2(g)=GC2(g)△H1=-296KJ?mol-1,2GC3(g)?2GC2(g)+C2(g)△H2=+198KJ?mol-1 2G(s)+3C2(g)?2GC3(g)△H3=
-790KJ?mol-1
-790KJ?mol-1
(4)对于可逆反应:2GC2(g)+C2(g)?2GC3(g)△H=aKJ?mol-1 图中两条曲线分别表示温度为T1和T2时体系中GC3的百分含量和时间的关系.GC3%T1时平衡常数K1、T2时平衡常数K2,则K1
>
>
K2(>、<、=).T2时在2L密闭容器中充入4moLGC2和3moLC2,在一定条件下达到平衡时GC2的转化率为90%,则这时的平衡常数数值是135
135
.(5)D2FC3溶液与E2(GC4)3溶液混合产生两种均溶于DCA溶液的难溶物质,写出两溶液混合所发生的离子反应方程式
3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓
3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓
(6)向Ba(AGC3)2溶液中滴加足量A2C2产生23.3克白色沉淀时,反应中电子转移总数物质的量为
0.2mol
0.2mol
.分析:短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,则A为H;B的最外层电子数是次外层电子数的二倍,则次外层电子数为2,最外层电子数为4,即B为C;C最外层电子数是其电子层数的三倍,电子层数为2,最外层电子数为6,即C为O;G与C同族,G为S,且两元素核外电子总数之和为8+16=24,与D、E两元素核外电子总数之和相等,则D为Na,E为Al符合;F的最外电子数是次外层电子数的二分之一,次外层电子数为8,最外层电子数为4,即F为Si.
(1)根据原子序数来确定元素的位置;
(2)元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,为甲醇;
(3)根据盖斯定律来计算反应热;
(4)由图可知先达到平衡时的温度大,则T2>T1,△H<0,温度低的平衡常数大;并利用化学平衡三段法计算平衡常数;
(5)Na2SiO3溶液与Al2(SO4)3溶液混合产生硫酸钠、硅酸、氢氧化铝;
(6)向Ba(HSO3)2溶液中滴加足量H2O2产生23.3克白色沉淀为BaSO4,利用S元素的化合价变化来计算转移电子数.
(1)根据原子序数来确定元素的位置;
(2)元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,为甲醇;
(3)根据盖斯定律来计算反应热;
(4)由图可知先达到平衡时的温度大,则T2>T1,△H<0,温度低的平衡常数大;并利用化学平衡三段法计算平衡常数;
(5)Na2SiO3溶液与Al2(SO4)3溶液混合产生硫酸钠、硅酸、氢氧化铝;
(6)向Ba(HSO3)2溶液中滴加足量H2O2产生23.3克白色沉淀为BaSO4,利用S元素的化合价变化来计算转移电子数.
解答:解:短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,则A为H;B的最外层电子数是次外层电子数的二倍,则次外层电子数为2,最外层电子数为4,即B为C;C最外层电子数是其电子层数的三倍,电子层数为2,最外层电子数为6,即C为O;G与C同族,G为S,且两元素核外电子总数之和为8+16=24,与D、E两元素核外电子总数之和相等,则D为Na,E为Al符合;F的最外电子数是次外层电子数的二分之一,次外层电子数为8,最外层电子数为4,即F为Si.
(1)Si的原子序数为14,位于元素周期表中第3周期第IVA族,故答案为:第3周期第IVA族;
(2)元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,为甲醇,其电子式为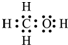 ,故答案为:
,故答案为: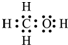 ;
;
(3)由①G(s)+C2(g)=GC2(g)△H1=-296KJ?mol-1,②2GC3(g)?2GC2(g)+C2(g)△H2=+198KJ?mol-1,根据盖斯定律可知,反应2G(s)+3C2(g)?2GC3(g)可由①×2-②得到,则反应热△H3=(-296KJ?mol-1)×2-(+198KJ?mol-1)=-790KJ?mol-1,故答案为:-790KJ?mol-1;
(4)由图可知先达到平衡时的温度大,则T2>T1,且2GC2(g)+C2(g)?2GC3(g)△H=-198KJ?mol-1,△H<0,降低温度平衡正向移动,则平衡常数大,所以K1>K2;
T2时在2L密闭容器中充入4moLGC2和3moLC2,在一定条件下达到平衡时GC2的转化率为90%,
2GC2(g)+C2(g)?2GC3(g)
开始 4 3
转化3.6 1.8 3.6
平衡0.4 1.2 3.6
平衡时的浓度分别为0.2mol/L、0.6mol/L、1.8mol/L,
则平衡常数K=
=135,故答案为:>;135;
(5)Na2SiO3溶液与Al2(SO4)3溶液混合产生硫酸钠、硅酸、氢氧化铝,离子反应为3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓,
故答案为:3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓;
(6)向Ba(HSO3)2溶液中滴加足量H2O2产生23.3克白色沉淀为BaSO4,S元素的化合价由+4升高到+6,转移电子数为
×(6-4)=0.2mol,
故答案为:0.2mol.
(1)Si的原子序数为14,位于元素周期表中第3周期第IVA族,故答案为:第3周期第IVA族;
(2)元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,为甲醇,其电子式为
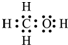 ,故答案为:
,故答案为: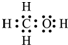 ;
;(3)由①G(s)+C2(g)=GC2(g)△H1=-296KJ?mol-1,②2GC3(g)?2GC2(g)+C2(g)△H2=+198KJ?mol-1,根据盖斯定律可知,反应2G(s)+3C2(g)?2GC3(g)可由①×2-②得到,则反应热△H3=(-296KJ?mol-1)×2-(+198KJ?mol-1)=-790KJ?mol-1,故答案为:-790KJ?mol-1;
(4)由图可知先达到平衡时的温度大,则T2>T1,且2GC2(g)+C2(g)?2GC3(g)△H=-198KJ?mol-1,△H<0,降低温度平衡正向移动,则平衡常数大,所以K1>K2;
T2时在2L密闭容器中充入4moLGC2和3moLC2,在一定条件下达到平衡时GC2的转化率为90%,
2GC2(g)+C2(g)?2GC3(g)
开始 4 3
转化3.6 1.8 3.6
平衡0.4 1.2 3.6
平衡时的浓度分别为0.2mol/L、0.6mol/L、1.8mol/L,
则平衡常数K=
| (1.8mmol/L)2 |
| (0.4mol/L)2×1.2mol/L |
(5)Na2SiO3溶液与Al2(SO4)3溶液混合产生硫酸钠、硅酸、氢氧化铝,离子反应为3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓,
故答案为:3SiO32-+2Al3++6H2O=2Al(OH)3↓+3H2SiO3↓;
(6)向Ba(HSO3)2溶液中滴加足量H2O2产生23.3克白色沉淀为BaSO4,S元素的化合价由+4升高到+6,转移电子数为
| 23.3g |
| 233g/mol |
故答案为:0.2mol.
点评:本题考查位置、结构、性质,元素的推断是解答本题的关键,综合性较强,注重对高考常考考点的考查,并熟悉元素化合物的性质来解答即可,(4)、(5)为学生解答的难点,题目难度较大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
 (2011?大兴区二模)对结构简式如图所示的有机化合物,下列说法不正确的是( )
(2011?大兴区二模)对结构简式如图所示的有机化合物,下列说法不正确的是( )
 (2011?大兴区二模)根据图回答,下列说法正确的是( )
(2011?大兴区二模)根据图回答,下列说法正确的是( )