题目内容
16.实验室测得1mol SO2发生下列化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol.当放出49kJ热量时,SO2转化率最接近于( )| A. | 40% | B. | 50% | C. | 80% | D. | 90% |
分析 依据热化学方程式定量关系计算消耗的二氧化硫物质的量,反应焓变是2mol完全反应放出的热量,结合转化率=$\frac{消耗量}{起始量}$×100%,由此分析解答.
解答 解:2SO2(g)+O2(g)═2SO3(g);△H=-196kJ/mol
2mol 196.6KJ
n 49kJ
n=$\frac{2mol×49KJ}{196KJ}$=0.5mol,
SO2的转化率=$\frac{0.5}{1}$×100%=50%;
故选B.
点评 本题考查了热化学方程式的计算分析,注意反应焓变的含义理解,掌握基础是关键,题目较简单.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
4.下列说法错误的是( )
| A. | 从1L1mol/L的氯化钠溶液中取出10ml后,其浓度仍是1mol/L | |
| B. | NaHSO4溶液与NaOH溶液反应的离子方程式:H++OH-=H2O | |
| C. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| D. | 氧化剂具有氧化性,是得到电子(或电子对偏向)的物质,反应时本身被还原 |
11.下列反应符合图示的是( )


| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 黑火药爆炸 | D. | 用焦炭制水煤气 |
1.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡后,测得A的浓度为0.3mol?L-1,保持温度不变,将容器的容积缩小到原来的一半,测得A的浓度增大为0.5mol?L-1,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数变大 |
5.如图实验装置或对实验现象的描述正确的是( )
| A. |  分馏装置 | B. | 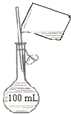 配制150 mL 0.10 mol•L-1盐酸 | ||
| C. |  烧瓶内溶液变蓝色 | D. |  出现砖红色沉淀 |
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.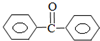 $→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
