题目内容
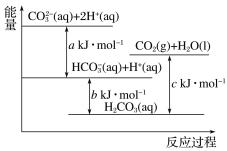
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
【答案】D
【解析】
A,HClO2的电离方程式为HClO2![]() H++ClO2-,电离平衡常数Ka=
H++ClO2-,电离平衡常数Ka=![]() ,由图像可见当c(HClO2)=c(ClO2-)时pOH=8,c(OH-)=1
,由图像可见当c(HClO2)=c(ClO2-)时pOH=8,c(OH-)=1![]() 10-8mol/L,c(H+)=1
10-8mol/L,c(H+)=1![]() 10-6mol/L,电离平衡常数Ka=1
10-6mol/L,电离平衡常数Ka=1![]() 10-6,A项错误;B,pOH=11时c(OH-)=1
10-6,A项错误;B,pOH=11时c(OH-)=1![]() 10-11mol/L,c(H+)=1
10-11mol/L,c(H+)=1![]() 10-3mol/L,溶液呈酸性,ClO2-部分转化成ClO2和Cl-的方程式为5ClO2-+4H+=4ClO2+Cl-+2H2O,B项错误;C,25℃pH=7时pOH=7,由图可见c(ClO2-)
10-3mol/L,溶液呈酸性,ClO2-部分转化成ClO2和Cl-的方程式为5ClO2-+4H+=4ClO2+Cl-+2H2O,B项错误;C,25℃pH=7时pOH=7,由图可见c(ClO2-)![]() c(HClO2)
c(HClO2)![]() c(ClO2),C项错误;D,同浓度的HClO2和NaClO2等体积的混合液中电荷守恒式为c(Na+)+c(H+)=c(ClO2-)+c(OH-),物料守恒式为2c(Na+)=c(HClO2)+c(ClO2-),两式整理得c(Na+)+c(OH-)=c(H+)+c(HClO2),D项正确;答案选D。
c(ClO2),C项错误;D,同浓度的HClO2和NaClO2等体积的混合液中电荷守恒式为c(Na+)+c(H+)=c(ClO2-)+c(OH-),物料守恒式为2c(Na+)=c(HClO2)+c(ClO2-),两式整理得c(Na+)+c(OH-)=c(H+)+c(HClO2),D项正确;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能共存,Al3++3OH-=Al(OH)3↓ |
B | pH =1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能共存,5Fe2++MnO4-+8H+= Mn2++5Fe3++4H2O |
C | 由水电离出的H+浓度为1×10-12 mol·L-1 | NH4+、Na+、NO3-、Cl- | 一定能共存,NH4++ H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能共存,2C1O- +SO2+H2O=2HC1O+SO32- |
A. A B. B C. C D. D