题目内容
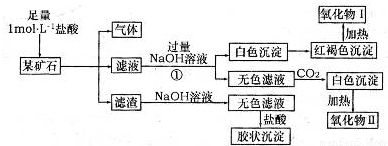
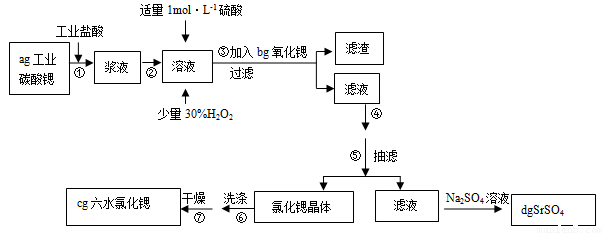
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图:
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
A.水 B.硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
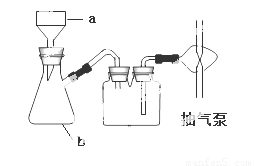
(4)指出下图中仪器b 的名称 , 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是 ,抽气使滤纸紧贴在漏斗瓷板上;
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。
(1)H2O2+2Fe2++2H+=2Fe3++2H2O ;
(2)调节pH,使Fe3+转化为氢氧化铁沉淀而除去,温度高有利于除去湿存水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去;
(3)蒸发浓缩 冷却结晶 D
(4)吸滤瓶 用蒸馏水润湿滤纸,微开水龙头;
(5)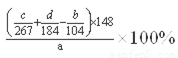
【解析】
试题分析:碳酸锶与盐酸反应生成氯化锶、水、二氧化碳.碳酸锶不溶于水,氯化锶易溶于水,反应离子方程式为:SrCO3+2H+=Sr2++H2O+CO2↑。溶液中大部分是氯化锶,所以加入硫酸后会先生成硫酸锶, 由于硫酸钡的溶解度小于硫酸锶,所以会进一步转化为硫酸钡沉淀。双氧水具有强氧化性,在酸性条件下,双氧水将Fe2+氧化为Fe3+,自身被还原为H2O。(1) 加入少量30%H2O2的作用,将亚铁离子氧化成三价铁离子;(2) 步骤③中氧化锶粉末的作用是调节pH,使Fe3+转化为氢氧化铁沉淀而除去;工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去;(3)步骤④进行的实验操作为蒸发浓缩、冷却结晶 ,步骤⑥中,洗涤氯化锶晶体最好选用氯化锶饱和溶液;(4) 仪器b 的名称吸滤瓶, 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上;(5)根据锶元素守恒,原工业碳酸锶粉末中碳酸锶的质量分数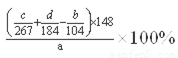 。
。
考点:以氯化锶的制备为载体,考查学生对工艺流程的理解、化学用语、元素周期律、物质的分离提纯、沉淀转化、对溶液浓度的理解与计算等,综合性较强,涉及的知识点多,难度中等,需要学生具备阅读分析能力和灵活运用知识的解决问题能力。

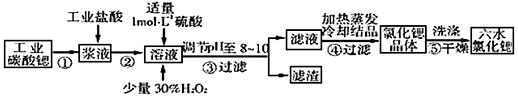
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
|
|
SrSO4 |
BaSO4 |
Sr(OH)2 |
|
Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |