题目内容
标准状况下,密度为0.717g/L的某气态烃0.56L,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重0.9g;再通过氢氧化钠溶液,溶液增重1.1g.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图.
解法1:
设该烃中C、H元素的质量分别为x、y g.
根据题意和题中数据:
CO2 ~ C H2O ~ 2H
44g 12g 18g 2g
1.1g x 0.9g y
44∶1.1=12∶x 18∶0.9=2∶y
x=0.3(g) y=0.1(g)
烃中C、H元素原子个数比
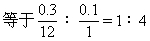
该烃实验式为CH4,式量为16.
该烃相对分子质量=0.717×22.4=16
该烃分子式为CH4,其分子空间结构示意图见下一解法的解题过程.
解法2:
设该烃为CmHn.此烃1mol完全燃烧生成CO2和H2O分别为xg和yg.
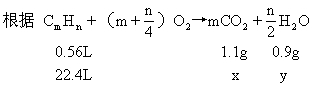
0.56∶22.4=1.1∶x 0.56∶22.4=0.9∶y
x=44(g) y=36(g)
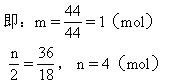
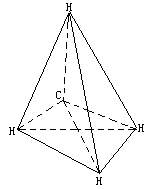
该烃分子式为CH4.其分子空间结构示意图为
解法3:
该烃摩尔质量=0.717×22.4=16(g/mol),只能是有机物中相对分子质量最小的CH4.
设该烃中C、H元素的质量分别为x、y g.
根据题意和题中数据:
CO2 ~ C H2O ~ 2H
44g 12g 18g 2g
1.1g x 0.9g y
44∶1.1=12∶x 18∶0.9=2∶y
x=0.3(g) y=0.1(g)
烃中C、H元素原子个数比
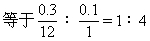
该烃实验式为CH4,式量为16.
该烃相对分子质量=0.717×22.4=16
该烃分子式为CH4,其分子空间结构示意图见下一解法的解题过程.
解法2:
设该烃为CmHn.此烃1mol完全燃烧生成CO2和H2O分别为xg和yg.
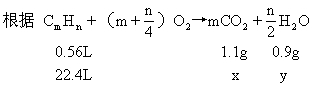
0.56∶22.4=1.1∶x 0.56∶22.4=0.9∶y
x=44(g) y=36(g)
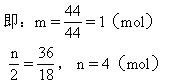
该烃分子式为CH4.其分子空间结构示意图为

解法3:
该烃摩尔质量=0.717×22.4=16(g/mol),只能是有机物中相对分子质量最小的CH4.
本题是在已知有机物完全燃烧时,涉及的有关物质量关系,判断其分子组成的典型定量计算题.其解法有三种.
第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.
第二种解法是通过烃的燃烧通式:
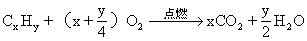
计算该烃1mol完全燃烧时,生成CO2和H2O物质的量,从而求得烃分子中C、H元素原子个数,求得其分子式
第三种解法是由本题特点决定的解法特例.即通过该烃在标准状况下的气体密度、计算相对分子质量为16.而相对分子质量为16的烃,是相对分子质量最小的甲烷,其分子式为CH4.
如上各解法均可求得该烃为甲烷,就可画出表示甲烷分子空间结构的正四面体分子构型.
第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.
第二种解法是通过烃的燃烧通式:
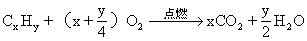
计算该烃1mol完全燃烧时,生成CO2和H2O物质的量,从而求得烃分子中C、H元素原子个数,求得其分子式
第三种解法是由本题特点决定的解法特例.即通过该烃在标准状况下的气体密度、计算相对分子质量为16.而相对分子质量为16的烃,是相对分子质量最小的甲烷,其分子式为CH4.
如上各解法均可求得该烃为甲烷,就可画出表示甲烷分子空间结构的正四面体分子构型.

练习册系列答案
相关题目