题目内容
臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,同时产生O2,则:
(1)该反应的化学方程式为:
(2)该反应中氧化剂的名称为
(3)若消耗0.1mol氧化剂,反应中转移电子的物质的量为
(1)该反应的化学方程式为:
2KI+O3+H2O=2KOH+I2+O2
2KI+O3+H2O=2KOH+I2+O2
;(2)该反应中氧化剂的名称为
臭氧
臭氧
,还原产物的化学式为KOH
KOH
;(3)若消耗0.1mol氧化剂,反应中转移电子的物质的量为
0.2mol
0.2mol
.分析:(1)臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,说明反应过程中有碘单质生成,反应中碘化钾是还原剂,臭氧作氧化剂得电子发生还原反应.
(2)反应中得电子化合价降低的物质是氧化剂;氧化剂对应的产物是还原产物.
(3)根据氧化剂和转移电子之间的关系式计算转移电子的物质的量.
(2)反应中得电子化合价降低的物质是氧化剂;氧化剂对应的产物是还原产物.
(3)根据氧化剂和转移电子之间的关系式计算转移电子的物质的量.
解答:解:(1)臭氧(O3)可以使湿润的淀粉碘化钾试纸变蓝,说明反应过程中有碘单质生成,反应中碘化钾是还原剂,臭氧作氧化剂得电子发生还原反应,所以是碘化钾和臭氧、水反应生成碘、氧气和氢氧化钾,
反应方程式为:2KI+O3+H2O=2KOH+I2+O2.
故答案为:2KI+O3+H2O=2KOH+I2+O2;
(2)该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物.
故答案为:臭氧; KOH;
(3)设转移电子的物质的量是x.
2KI+O3+H2O=2KOH+I2+O2 转移电子
1mol 2mol
0.1mol x
x=0.2mol
故答案为:0.2 mol.
反应方程式为:2KI+O3+H2O=2KOH+I2+O2.
故答案为:2KI+O3+H2O=2KOH+I2+O2;
(2)该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物.
故答案为:臭氧; KOH;
(3)设转移电子的物质的量是x.
2KI+O3+H2O=2KOH+I2+O2 转移电子
1mol 2mol
0.1mol x
x=0.2mol
故答案为:0.2 mol.
点评:本题以臭氧的性质为载体考查了反应方程式的书写、氧化剂和还原产物的判断等知识点,难度不大,转移该反应中臭氧并不都作氧化剂,只有
的作氧化剂.
| 1 |
| 3 |

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
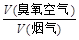 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。 流量比为y,请通过计算列出y与x的关系式.
流量比为y,请通过计算列出y与x的关系式.