题目内容
将化合物A的蒸气2mol充入0.5L容器中加热发生分解反应2A(g)?B(g)+nC(g),反应到2min时容器中B的浓度为1.6mol/L,并测得这段时间内,用C的浓度变化表示的平均反应速率V(c)=1.6mol/(L*min)
(1)求化学方程式中的计量数n的值
(2)求用B表示的反应速率
(3)求A的转化率.
(1)求化学方程式中的计量数n的值
(2)求用B表示的反应速率
(3)求A的转化率.
考点:化学平衡的计算
专题:化学平衡专题
分析:根据v=
计算出2min内用物质B表示的平均反应速率,再利用速率之比等于化学计量数之比计算n;根据反应用去了B的物质的量可以求得A的转化了的物质的量,进而求A的转化率.
| △c |
| △t |
解答:
解:(1)2min内用物质B表示的平均反应速率v(B)=
=0.8mol/(L?min),
速率之比等于化学计量数之比,所以:0.8mol/(L?min):1.6mol/(L?min)=1:n,
解得:n=2
答:化学方程式中的计量数n的值为2;
(2)2min内用物质B表示的平均反应速率v(B)=
=0.8mol/(L?min),
答:用B表示的反应速率为;0.8mol/(L?min);
(3)2min时容器中生成B的物质的量为1.6mol/L×0.5L=0.8mol,根据反应2A(g) ?B(g)+2C(g)中A与B的关系可知,反应用去A的物质的量为0.8mol×2=1.6mol,所以A的转化率为
?B(g)+2C(g)中A与B的关系可知,反应用去A的物质的量为0.8mol×2=1.6mol,所以A的转化率为
×100%=80%,答:A的转化率为80%.
| 1.6mol/L |
| 2min |
速率之比等于化学计量数之比,所以:0.8mol/(L?min):1.6mol/(L?min)=1:n,
解得:n=2
答:化学方程式中的计量数n的值为2;
(2)2min内用物质B表示的平均反应速率v(B)=
| 1.6mol/L |
| 2min |
答:用B表示的反应速率为;0.8mol/(L?min);
(3)2min时容器中生成B的物质的量为1.6mol/L×0.5L=0.8mol,根据反应2A(g)
 ?B(g)+2C(g)中A与B的关系可知,反应用去A的物质的量为0.8mol×2=1.6mol,所以A的转化率为
?B(g)+2C(g)中A与B的关系可知,反应用去A的物质的量为0.8mol×2=1.6mol,所以A的转化率为| 1.6mol |
| 2mol |
点评:考查化学反应速率的有关计算等,难度不大,注意同一化学反应,同一时间段内,各物质的化学反应速率之比等于其计量数之比.

练习册系列答案
相关题目
下列反应属于取代反应的是( )
| A、丙烯与氯化氢在一定条件下制取2-氯丙烷 |
| B、酒精与浓硫酸混合液迅速升温至170℃的反应 |
| C、甲烷制四氯化碳 |
| D、甲烷与氧气的混合气体在点燃下的反应 |
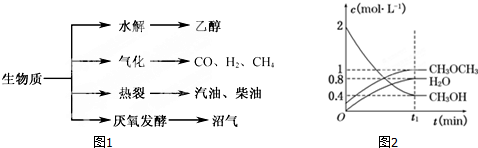
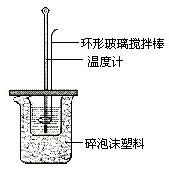 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题