题目内容
20.下列指定反应的离子方程式正确的是( )| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
分析 A.电荷不守恒;
B.氨水过量,反应生成亚硫酸铵;
C.离子个数配比不符合物质结构组成;
D.石灰水足量,反应生成碳酸钙、碳酸铵和水.
解答 解:A.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.用过量氨水吸收工业尾气中的SO2,离子方程式:2NH3•H2O+SO2═2NH4++SO32-+H2O,故B正确;
C.向氢氧化钡溶液中加入稀硫酸,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.向碳酸氢铵溶液中加入足量石灰水,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写判断,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,离子反应应遵循客观事实、原子个数、电荷守恒规律,题目难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
10.将W1g光亮铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,洗涤、干燥后称其质量为W2g.下列所插入的物质与铜丝质量关系不正确的是( )
| A. | 石灰水Wl<W2 | B. | COW1=W2 | ||
| C. | 稀H2SO4溶液W1>W2 | D. | 乙醇W1<W2 |
11.下列有机物能使酸性KMnO4溶液褪色的是( )
①CH3CH2CH3 ② ③CH3CH2CH2Br
③CH3CH2CH2Br
④CH3CH2CH2OH ⑤CH3CH2CHO ⑥HCOOCH2CH3.
①CH3CH2CH3 ②
 ③CH3CH2CH2Br
③CH3CH2CH2Br④CH3CH2CH2OH ⑤CH3CH2CHO ⑥HCOOCH2CH3.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ④⑤⑥ |
8.将铁片和碳棒用导线连接后放入稀盐酸中,发生原电池反应,下列叙述错误的是( )
| A. | 溶液的H+浓度减小 | B. | 溶液中的Fe2+浓度增大 | ||
| C. | 溶液中的Cl-浓度增大 | D. | 溶液的密度增大 |
12.下列叙述错误的是( )
| A. | 与  互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| B. | 含有5个碳原子的某饱和链烃,其一氯取代物的结构可能有3种 | |
| C. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,得到的结构可能有6种 | |
| D. | 菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
9.烯烃在一定条件下发生氧化反应时,碳碳双键发生断裂,RCH═CHR1可以氧化成RCHO和R1CHO.在该条件下,下列烯烃分别被氧化后,产物中可能有乙醛的是( )
| A. | CH3CH2CH=CHCH2CH3 | B. | CH2=CHCH2CH2CH3 | ||
| C. | CH3CH=CHCH2CH2CH3 | D. | CH3CH2CH=C(CH3)2 |
10.除第一周期外,关于同周期主族元素的下列变化规律的叙述中不正确的是( )
| A. | 从左到右,原子半径逐渐减小 | |
| B. | 从左到右,元素原子的得电子能力减弱,失电子能力增强 | |
| C. | 从左到右,气态氢化物的稳定性增强 | |
| D. | 从左到右,元素最高价氧化物对应水化物碱性减弱,酸性增强 |

 的化学反应方程式
的化学反应方程式 、
、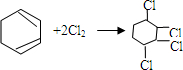 .
.