题目内容
15.若用MnO2与200mL物质的量浓度为12mol/L的浓盐酸共热反应制得氯气4.48L(标准状况).求:①消耗MnO2的质量;
②被氧化的HCl的物质的量;
③若反应后溶液的体积不变,则反应后溶液中Cl-物质的量浓度是多少?(O-16 Mn-55)
分析 ①发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,再根据方程式计算消耗二氧化锰物质的量,根据m=nM计算二氧化锰的质量;
②被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量;
③根据氯元素守恒计算反应后溶液中Cl-物质的量浓度.
解答 解:①氯气的物质的量为$\frac{4.48}{22.4L/mol}$=0.2mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 1
0.2mol 0.2mol
则m(MnO2)=0.2mol×87g.mol-1=17.4g,
答:需要消耗MnO2的质量为17.4g;
②被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量=2n(Cl2)=2×0.2mol=0.4mol,
答:被氧化的HCl的物质的量是0.4mol;
③反应后溶液中的Cl-减少了2×n(Cl2)=0.4mol,由氯元素守恒,反应后溶液中n(Cl-)=12mol•L-1×0.2L-0.4mol=2mol,则反应后溶液中Cl-物质的量浓度是$\frac{2mol}{0.2L}$=10mol/L,
答:反应后溶液中Cl-物质的量浓度是10mol/L.
点评 本题考查学生化学反应方程式的计算、氧化还原反应计算,难度不大,注意(2)(3)中利用守恒法计算解答.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
5.既能与酸(H+)反应,又能与碱(OH-)反应的是( )
①MgO ②Al2O3③NaHSO4 ④NaHCO3 ⑤NH4HS.
①MgO ②Al2O3③NaHSO4 ④NaHCO3 ⑤NH4HS.
| A. | ②④⑤ | B. | ③④ | C. | ②⑤ | D. | ③④⑤ |
6.部分短周期元素的有关信息为:
根据上表中信息,判断以下叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Q | 与L同族 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
20.下列叙述正确的是( )
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
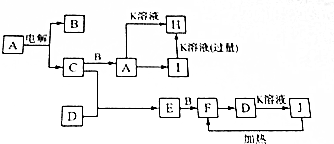
 .
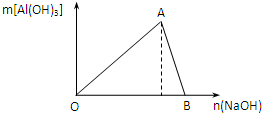
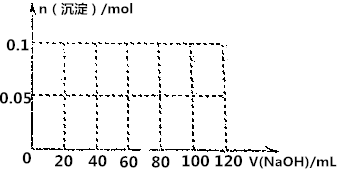
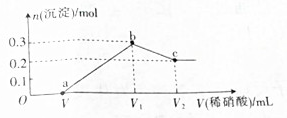
.
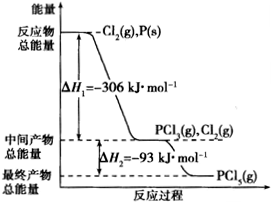 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).