题目内容
(8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
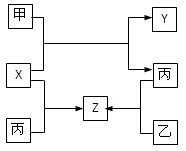
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体,
试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式____________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:________________________ _ 。
【答案】
⑴①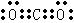 (2分)
②2Mg+CO2==2MgO+C(2分)
(2分)
②2Mg+CO2==2MgO+C(2分)
⑵①FeBr3(2分) ②3Cl2+2Fe2++4Br-==2Fe3++2Br2+6Cl-(2分)
【解析】由框图可知反应甲+X→丙+Y属于置换反应。
(1)若甲为短周期金属,乙、丙是非金属,在常见金属能置换非金属的反应中只有镁和二氧化碳符合,故甲是镁,X是二氧化碳,丙是碳、Y是MgO。碳和二氧化碳反应生成CO,Z是CO。碳不完全燃烧生成CO,乙是氧气。
(2)在常见的单质液体中只有单质溴(金属汞不常见,很少涉及到),即丙是单质溴。Y和Z具有相同的阳离子,根据转化关系可知X中也含有该元素,故该元素是变价的金属元素,常见的变价金属是铁,乙是单质铁,因此Z是FeBr3,则X是FeBr2。能把FeBr2氧化生成FeBr3和单质溴的单质气体应氯气,即甲是氯气。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
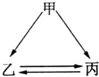 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①C ②H2O2 ③Na ④Fe ⑤HNO3.
| A、仅①③④ | B、仅①②⑤ | C、仅①②③⑤ | D、①②③④⑤ |
 如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是①Fe;②HNO3;③Na;④C( )
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是①Fe;②HNO3;③Na;④C( )| A、①②③ | B、②③④ | C、①②④ | D、①②③④ |
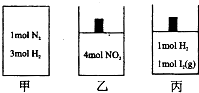 如图所示的甲、乙、丙三个绝热容器中分别发生的反应为:
如图所示的甲、乙、丙三个绝热容器中分别发生的反应为:甲:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
乙:2NO2(g)?N2O4
丙:H2(g)+I2(g)?2HI(g)
则下列有关说法不正确的是( )
| A、若甲的体积为2L,经过10秒后反应达到平衡状态,放出热量为55.44U,则H2的反应速率是0.09mol/(L?s) | B、若甲、乙中反应达到平衡时的体积相同,则两容器中所含物质的量可能相同 | C、若乙、丙中反应达到平衡时的体积、压强均相同,则乙中NO2的转化率为50% | D、若甲、乙、丙中反应均达到平衡状态时,则甲中物质的平均相对分子质量不变,乙中物质的颜色不变,丙中的温度不变 |
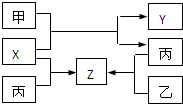 (2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系:
(2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系: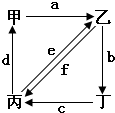 如图所示,甲、乙、丙、丁分别代表CO2、Na2CO3、NaOH、NaHCO3四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系.对于图中两种物质间的转化,通过一步反应就能实现的有 ( )
如图所示,甲、乙、丙、丁分别代表CO2、Na2CO3、NaOH、NaHCO3四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系.对于图中两种物质间的转化,通过一步反应就能实现的有 ( )