题目内容
【题目】把一定质量的镁、铝混合物投入到1molL﹣1的盐酸中,待金属完全溶解后,向溶液中加入1mol,L﹣1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: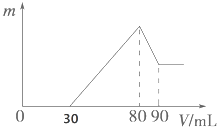
(1)写出下列各段反应的离子方程式
①0﹣30mL .
②30﹣80mL .
③80﹣90mL .
(2)原溶液中盐酸的体积为mL
(3)原镁铝混合物中镁、铝的物质的量之比为 .
【答案】
(1)①H++OH﹣=H2O;Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓;Al(OH)3+OH﹣=[Al(OH)4]﹣
(2)80
(3)1:1.
【解析】(1)①根据图可知,0﹣30mL加入氢氧化钠溶液后,首先发生的反应是中和过量的酸:H++OH﹣=H2O;
②30﹣80段是沉淀镁离子、铝离子离子,反应的离子方程式为:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓;
③80﹣90mL是Al(OH)3的溶解,反应的离子方程式为:Al(OH)3+OH﹣=[Al(OH)4]﹣;
(2)加入80mL氢氧化钠溶液时沉淀达到最大量,此时溶质为NaCl,根据质量守恒可知:n(HCl)=n(NaCl)=n(NaOH)=1mol/L×0.08L=0.08mol,
则原元素溶液的体积为: ![]() =0.08L=80mL;
=0.08L=80mL;
(3)从横坐标80mL到90mL这段可计算出n[Al(OH)3] = 1 mol/L × (0.09L ﹣ 0.08L) = 0.01 mol,则n(Al)=n[Al(OH)3]=0.01mol,所以沉淀Al3+需要的OH﹣为0.03mol,即消耗NaOH溶液的体积为30mL,则沉淀镁离子消耗氢氧化钠溶液的体积为:80mL ﹣ 30mL ﹣ 30mL = 20mL,氢氧化钠的物质的量为:1 mol/L × 0.02L = 0.02 mol,根据质量守恒定律可知:n(Mg) = ![]() n(NaOH) = 0.01 mol,所以原镁铝混合物中镁、铝的物质的量之比为0.01mol : 0.01mol = 1:1.
n(NaOH) = 0.01 mol,所以原镁铝混合物中镁、铝的物质的量之比为0.01mol : 0.01mol = 1:1.
所以答案是:(1)①①H++OH﹣=H2O
②Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓
③Al(OH)3+OH﹣=[Al(OH)4]﹣
(2)80
(3)1:1.