题目内容
【题目】室温下有下列四种溶液,下列叙述正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸溶液 | 氢氧化钠溶液 | 氨水 |
A.①、②、③三种溶液的物质的量浓度大小为:①=③>②
B.相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①>②
C.②、③两溶液等体积混合,所得溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.①、③溶液以体积比为9:11混合,则混合溶液的pH=4
【答案】C
【解析】
分析题给表格,①③溶液分别为强酸、强碱溶液,在水溶液中完全电离。②④溶液分别为弱酸、弱碱溶液,在水溶液中部分电离。据此分析。
A.盐酸为强电解质,pH=3的盐酸,其物质的量的浓度为10-3mol·L-1,氢氧化钠为强电解质,pH=11的氢氧化钠溶液,其物质的量浓度为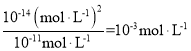 ,醋酸为弱酸,在水溶液中部分电离,pH=3的醋酸溶液,其物质的量浓度大于pH=3的盐酸溶液。故①、②、③三种溶液的物质的量浓度大小为:①=③<②,A项错误;
,醋酸为弱酸,在水溶液中部分电离,pH=3的醋酸溶液,其物质的量浓度大于pH=3的盐酸溶液。故①、②、③三种溶液的物质的量浓度大小为:①=③<②,A项错误;
B.pH相同,相同体积的①、②溶液,溶液的物质的量:②>①,则相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①<②,B项错误;
C.②、③两溶液等体积混合,得到了醋酸和醋酸钠的混合溶液,溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;
D.根据以上分析,①、③溶液其物质的量浓度相等,二者混合,发生反应:HCl+NaOH=NaCl+H2O,反应中HCl和NaOH的物质的量之比为1:1,设①溶液体积为9V,则③溶液体积为11V,反应后所得溶液为NaCl和NaOH的混合溶液,混合溶液中c(OH-)=![]() ,则溶液的pH=10,D项错误;
,则溶液的pH=10,D项错误;
答案选C。

【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应