题目内容
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol/L。
【答案】
(1)5.8 5.4 (2) 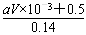
【解析】本题主要应用反应过程中电子守恒定律和元素守恒来解决。
(1)V(NO)+V(NO2)=11.2L ①
再由电子守恒可得:
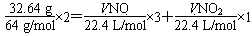
由①②解得:V(NO)=5.8L,V(NO2)=5.4L。
(2)由氮元素的守恒:N最终以NO、NO2及NaNO3形式存在。
因此,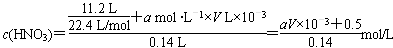 。
。

练习册系列答案
相关题目
 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。