��Ŀ����
(14��) ��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)  CH3OH(g)
CH3OH(g)
��ӦII�� CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ��mol
��CH3OH(l)+ O2(g) �� CO(g) + 2H2O(l) ��H��
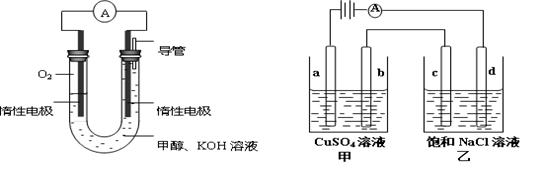
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�������������ͼ��ʾ�ĵ��װ�á�
�� �õ�ظ����ĵ缫��ӦΪ ��
�� ����һ��ʱ������Һ��pH ���������䡢��С����
���øõ������Դ�����������ͼ��ʾװ��(a��b��c��d��Ϊʯī�缫)��������װ250mL0.04mol/LCuSO4��Һ��������װ300mL����NaCl��Һ��д��c�缫�ĵ缫��Ӧ �������£���300mL����Һ��pHΪ13ʱ���Ͽ���Դ�����ڼ״����������O2�����Ϊ mL(��״��) ����������м�����������ijһ�����ʣ�����ʹ��Һ�ָ���ԭ��״̬���������� (��д���) ��
| A��CuO | B��CuCO3���� | C��Cu(OH)2 | D��Cu2(OH)2CO3 |
��1�� I ��2�֣���2�� ��H����442.8 kJ�Mmol��2�֣�
��3����CH3OH + 8OH- = CO32- + 6H2O + 6e-��2�֣�
�ڼ�С��2�֣��� 2Cl- - 2e-=Cl2�� ��2�֣�168��2�֣� D��2�֣�
���������������1����ӦIԭ��������100%������ԭ�Ӿ��ã���2��CH3OH(l)+ O2(g) �� CO(g) + 2H2O(l)
��H����H1����H2 ��2��H3 = ��442.8 kJ�Mmol����3�����Խ����£��״�ʧȥ��������CO32-��CH3OH + 8OH- = CO32- + 6H2O + 6e-��CH3OH + 8OH-�� 6e- = CO32- + 6H2O���ڷ�Ӧ���ܷ���ʽΪ2CH3OH + 4OH- + 3O2 = 2CO32- + 6H2O������һ��ʱ�����Һ��pH���٣��۵�ⱥ��ʳ��ˮ����ʽΪ
2NaCl+2H2O=" 2NaOH" + H2+ Cl2����Ӧ������n(OH-)="0.3��0.1=0.03mol=" n(e-)��v(O2)=0.03��4��22.4��1000=168mL�����������������������������Ȳ���ͭ0.01mol�����������0.005mol���ʼ���Cu2(OH)2CO3���ָܻ�ԭ��״̬��
���㣺���黯ѧԭ���ۺ�֪ʶ��

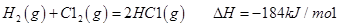
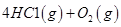
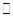
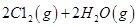

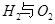 ��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________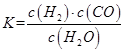
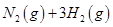
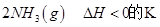 =0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ
=0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ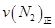 ____________
____________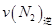 �������������������ȷ������
�������������������ȷ������
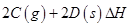 ���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
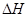 ___________0�������������
___________0������������� B��������ѹǿ���ֲ���
B��������ѹǿ���ֲ���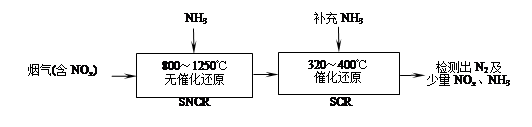
 2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������
2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������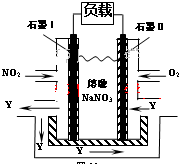
 CH3OH(g)+H2O(g)��ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol��1)�ı仯��
CH3OH(g)+H2O(g)��ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol��1)�ı仯��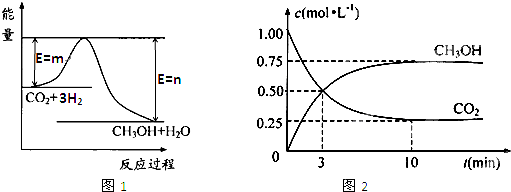
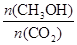 ������� ��
������� ��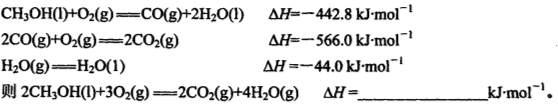
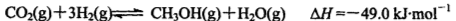
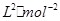 mol;
mol;

 ���>������<����=����
���>������<����=���� 2SO3��g�� ��H="-197" kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱����
2SO3��g�� ��H="-197" kj��mol����ʼʱ��10 L���ܱ������м���4��0 mol SO2��g����10��0 mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�197kJ�����������¶��µ�ƽ�ⳣ��K= �������¶�K�� �������С�䡱����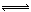 2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����
2SO3��g������ѧ��ȤС���ͬѧ̽����������������ʱ���ı�ijһ����ʱ��������Ӧ��Ӱ�죬������ʵ���������������й�ϵͼ�������ж�����ȷ���� ������ĸ����
 2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�
2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش� ��
�� �Ĵ���ʽ��ʾ����
�Ĵ���ʽ��ʾ����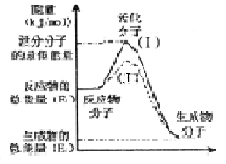
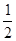 O2(g)�TH2O(g)����H=-241��5kJ/mol���÷�Ӧ�Ļ��Ϊ167�� 4kJ/mol�������淴Ӧ�Ļ��Ϊ________________��
O2(g)�TH2O(g)����H=-241��5kJ/mol���÷�Ӧ�Ļ��Ϊ167�� 4kJ/mol�������淴Ӧ�Ļ��Ϊ________________��