题目内容
【题目】Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)向CuSO4溶液中滴加氨水至深蓝色透明溶液时,发生的离子反应方程式 .
(2)硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图: 
①SO42﹣中S原子的轨道杂化类型是;
②A中碳原子的轨道杂化类型为 .
③1mol氨基乙酸钠含有σ键的数目为 .
(3)元素金(Au)处于周期表中的第六周期,与Cu同族.一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为(填“密置层”、“非密置层”);该晶体中,原子之间的作用力是;
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构相似,该晶体储氢后的化学式应为 . 若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为 . (含a的表达式)
【答案】
(1)2Cu+O2+2H2SO4(稀) ![]() 2CuSO4+2H2O
2CuSO4+2H2O
(2)sp3;sp2sp3;8NA
(3)密置层;金属键
(4)H8AuCu3;![]() g/cm3
g/cm3
【解析】解:(1)加热条件下,Cu和稀硫酸、氧气发生氧化还原反应生成硫酸铜和水,根据反应物、生成物和反应条件书写方程式为2Cu+O2+2H2SO4(稀) ![]() 2CuSO4+2H2O,所以答案是:2Cu+O2+2H2SO4(稀)
2CuSO4+2H2O,所以答案是:2Cu+O2+2H2SO4(稀) ![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
(2.)①硫酸根离子中S原子价层电子对个数是4且不含孤电子对,S原子杂化方式为sp3,所以答案是:sp3;②根据A的结构简式可知,A中酯基中的碳周围有一个碳双键和两个单键,另一个碳周围有四个单键,所以碳原子的杂化方式为sp2 sp3 , 所以答案是:sp2 sp3;③1个氨基乙酸钠(H2N﹣CH2﹣COONa)中含有两个H﹣N键,两个C﹣H键,一个碳碳单键,一个碳氮单键,一个碳氧单键和一个碳氧双键,所以1mol氨基乙酸钠中含有的σ键的数目为8NA , 所以答案是:8NA;
(3.)一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为密置层,该晶体是由金属晶体,原子之间存在金属键;所以答案是:密置层;金属键;
(4.)该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,则在金属晶胞内部有8个H原子,该晶胞中含有Au原子个数=8× ![]() =1、Cu原子个数=6×
=1、Cu原子个数=6× ![]() =3,据此判断其化学式为H8AuCu3;若Cu原子与Au原子的距离为a cm,则晶胞棱长=
=3,据此判断其化学式为H8AuCu3;若Cu原子与Au原子的距离为a cm,则晶胞棱长= ![]() acm,晶胞体积=(
acm,晶胞体积=( ![]() acm)3 , 晶胞密度=
acm)3 , 晶胞密度= ![]() =
= ![]() g/cm3=
g/cm3= ![]() g/cm3 , 所以答案是:H8AuCu3;
g/cm3 , 所以答案是:H8AuCu3; ![]() g/cm3 .
g/cm3 .

 名师点睛字词句段篇系列答案
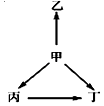
名师点睛字词句段篇系列答案【题目】下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
|
A | S | SO2 | SO3 | H2SO4 | |
B | N2 | NH3 | NO | NO2 | |
C | CuO | Cu | Cu(OH)2 | CuCl2 | |
D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
A.A
B.B
C.C
D.D
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |

A.A
B.B
C.C
D.D