题目内容
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
请回答
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
_______________________________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L________ , 混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+)(填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c(Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号)
(14分)
(1) a = 7,HA是强酸 ;a >7 ,HA是弱酸
(2)否,=
(3)弱,c(Na+)>c(A-)>c(OH-)>c(H+)
(4) 10-5 10-5 -10-9
(5)大于 ,CDBA
解析:

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A、四种气态烃中至少有两种互为同分异构体 | B、可以用酸性高锰酸钾溶液鉴别乙和丙 | C、丙分子中所有原子均在同一平面上 | D、乙和丁属于同系物 |
(14分)常温下,将某一元酸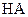 和
和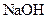 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):
| 实验编号 | 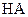 物质的量浓度 物质的量浓度( 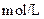 ) ) | 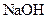 物质的量浓度 物质的量浓度( 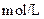 ) ) | 混合溶液的 |
| 甲 | 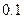 | 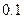 |  |
| 乙 |  |  |  |
| 丙 |  | 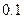 |  |
| 丁 |  |  |  |
(1)仅依据甲组数据分析,
 的取值范围为 。
的取值范围为 。(2)从乙组情况分析,
 是否一定等于
是否一定等于 (选填“是”或“否”)。若
(选填“是”或“否”)。若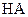 为弱酸,计算出该混合溶液达平衡时
为弱酸,计算出该混合溶液达平衡时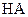 电离常数
电离常数 的近似值是 (用含
的近似值是 (用含 代数式表示)。
代数式表示)。(3)丙组混合溶液
 的原因是 ,该组混合溶液中离子浓度的大小关系是 。
的原因是 ,该组混合溶液中离子浓度的大小关系是 。(4)若把某离子水解的物质的量占某离子总物质的量的百分数叫做“水解度”,依据丁组数据,推知
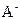 在该条件下的水解度是 ,该溶液中,水电离出的
在该条件下的水解度是 ,该溶液中,水电离出的 是
是  。
。 (14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
__________________________________________
 _____________________________________。
_____________________________________。(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2 mol/L________ ,混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+) (填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c (Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号)
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合后溶液的pH |
|
甲 |
0.2 |
0.2 |
pH = a |
|
乙 |
C1 |
0.2 |
pH = 7 |
|
丙 |
0.2 |
0.1 |
pH >8 |
|
丁 |
0.1 |
0.1 |
pH = 9 |
请回答
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
_______________________________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2 mol/L________ , 混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+) (填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c (Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号)