题目内容
9.阅读课本55页从海水中提取镁的步骤,回答下列问题:(1)用海滩上的贝壳制取Ca(OH)2的有关反应方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2
(2)写出制取Mg(OH)2的化学方程式MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
(3)工业采用电解MgCl2可得到Mg,写出反应方程式,并在方程式上标明电子的转移方向和数目

(4)利用电解MgCl2可制得的氯气和粉末状熟石灰可制得漂白粉,反应的方程式为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O.
分析 (1)用海滩上的贝壳制取Ca(OH)2的反应是,碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水生成氢氧化钙;
(2)利用氢氧化钙和海水中的氯化镁反应生成氢氧化镁沉淀和氯化钙;
(3)氯化镁电解反应没意识化合价+2价变化为0价,氯元素化合价-1价变化为0价,电子转移2e-,标注双线桥法写出;
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,原子守恒配平书写化学方程式.
解答 解:(1)用海滩上的贝壳制取Ca(OH)2的反应是,碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水生成氢氧化钙,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O═Ca(OH)2;
(2)利用氢氧化钙和海水中的氯化镁反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,
故答案为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;
(3)氯化镁电解反应没意识化合价+2价变化为0价,氯元素化合价-1价变化为0价,电子转移2e-,标注双线桥法写出的化学方程式为: ,
,
故答案为: ;
;
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,原子守恒配平书写化学方程式,2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O.
点评 本题考查了海水提镁的过程分析,和步骤反应,主要是化学方程式书写方法,掌握物质性质和化学基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.一化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol•L-1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
则混合溶液中c(HCO3-)为( )
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
| A. | 1.00mol•L-1 | B. | 0.50mol•L-1 | C. | 1.50mol•L-1 | D. | 2.00mol•L-1 |
19.已知非金属单质在碱性条件下易发生歧化反应,而其生成物在酸性条件下能够发生归中反应,现将aKOH、bH2O、cKCl、dKClO、eCl2、fKClO3可组成一个氧化还原反应,则下列有关说法错误的是( )
| A. | c、d、f之比可能为16:1:3 | |
| B. | 一定有a=2e,b=e | |
| C. | 若n(KClO):n(KClO3)=1:1,则a、b、c、d、e、f依次为8:4:6:1:4:1 | |
| D. | 若将该方程式拆开写成两个“半反应”,其中一定有Cl2-2e-=2Cl- |
4.常温下,将铜片投入到下列溶液中,会产生气体的是( )
| A. | 稀硫酸 | B. | 稀盐酸 | C. | 浓硝酸 | D. | 浓硫酸 |
1.从海水中提取镁时,涉及不到的化学反应是( )
| A. | MgCl2+Ca(OH)2═CaCl2+Mg(OH)2↓ | B. | Mg(OH)2+2HCl═MgCl2+2H2O | ||
| C. | Mg(OH)2+H2SO4═MgSO4+2H2O | D. | MgCl2$\frac{\underline{\;通电\;}}{熔融}$Mg+Cl2↑ |
18.下列说法不正确的是( )
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 0.1mol•L-1的NaHCO3溶液中C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.1mol•L-1的NaHA溶液pH=5,则溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) | |
| D. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
19.向0.1mol•L-1的碳酸钠溶液中通入少量二氧化碳气体时,一定会引起的变化是( )
| A. | 溶液中的c(CO32-)增大 | B. | 溶液的pH减小 | ||
| C. | 溶液中的c(HCO3-)减小 | D. | 溶液中的c(OH-)增大 |
 ,其一氯代物的结构简式是
,其一氯代物的结构简式是 ;其中一氯代物种类最多的是
;其中一氯代物种类最多的是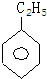 .(均填结构简式)
.(均填结构简式)