题目内容
如右图所示,已知A元素的最低化合价为-3,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多一个。试完成下列问题:
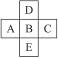
(1)写出它们的元素符号:
A_________,B_________,C_________,D_________,E_________。
(2)它们的气态氢化物稳定性最弱的是_________。
(3)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是_________。

(1)写出它们的元素符号:
A_________,B_________,C_________,D_________,E_________。
(2)它们的气态氢化物稳定性最弱的是_________。
(3)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是_________。
(1)P S Cl O Se
(2)H2Se
(3)HClO4、H2SO4、H3PO4
(2)H2Se
(3)HClO4、H2SO4、H3PO4
由A的最低负价为-3,说明A的最高正价为+5,原子核外最外层有5个电子,为ⅤA族的元素,最高价氧化物的化学式为A2O5,由A2O5中含氧的质量分数为56.34%,可求出A的质量数,再根据质量数=中子数+质子数,从而可以确定A的质子数,进而确定A。其他元素根据在周期表中与A的位置关系即可确定。
确定A: ×100%=56.34%
×100%=56.34%
得:Ar(A)="31 " 则A的质子数为 =15
=15
故A元素为磷元素。
确定A:
 ×100%=56.34%
×100%=56.34%得:Ar(A)="31 " 则A的质子数为
 =15
=15故A元素为磷元素。

练习册系列答案
相关题目




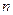 ,则Y的原子序数不可能是( )
,则Y的原子序数不可能是( )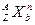 ,按下列要求各举一例:
,按下列要求各举一例: