题目内容
【题目】苯是重要的化工原料,以下是某酮酸E的合成路线。
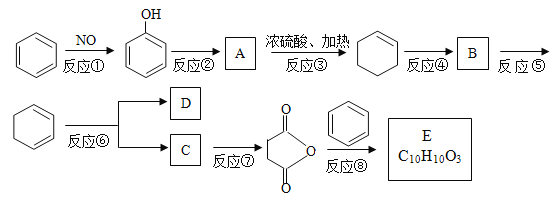
已知:
CH3CH=CHCH3能被氧化成乙酸;
②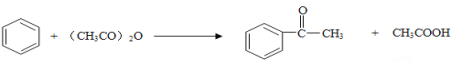
(1)以上合成路线中,属于氧化反应的有:反应⑥和反应________(填反应编号);反应⑤的反应条件是_________________________。
(2)写出结构简式A_______________________;B______________________。
(3)已知C的分子式为C4H6O4,则D的结构简式为______________________;分离C和D的方法是______________。
(4)不能由![]() 直接制取
直接制取![]() ,原因是_____________________________________。
,原因是_____________________________________。
(5)写出反应⑧的化学方程式____________________________________________。
【答案】 ① 碱的醇溶液、加热 

![]() 蒸馏或结晶法 苯分子中的碳碳键是一种特殊的键,加氢只能生成环己烷。
蒸馏或结晶法 苯分子中的碳碳键是一种特殊的键,加氢只能生成环己烷。 
【解析】根据有机物官能团的结构和性质,结合反应条件、题干已知信息和转化关系图首先判断出有机物的结构简式,然后依据问题分析解答。
根据各物质转化关系,![]() 发生氧化反应得
发生氧化反应得 ,
, 与氢气发生加成反应得A为
与氢气发生加成反应得A为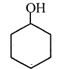 ,A在浓硫酸作用下发生消去反应得
,A在浓硫酸作用下发生消去反应得![]() ,
,![]() 与氯气加成得B为
与氯气加成得B为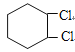 ,B发生消去反应得
,B发生消去反应得![]() ,
,![]() 发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,根据反应⑦的生成物结构简式可知C发生脱水反应生成
发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,根据反应⑦的生成物结构简式可知C发生脱水反应生成 ,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为
,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为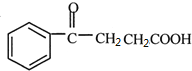 ,则
,则
(1)根据上面的分析可知,以上合成路线中,属于氧化反应的有:反应⑥和反应①,反应⑤为卤代烃的消去反应,所以反应条件是氢氧化钠醇溶液、加热;(2)根据上面的分析可知,A为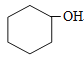 ,B为
,B为 ;(3)根据上面的分析可知,D为HOOCCOOH,C和D都是二元羧酸,它们能互溶但沸点不同,所以分离C和D的方法是蒸馏;(4)由于苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷,所以不能由
;(3)根据上面的分析可知,D为HOOCCOOH,C和D都是二元羧酸,它们能互溶但沸点不同,所以分离C和D的方法是蒸馏;(4)由于苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷,所以不能由![]() 直接制取
直接制取![]() ;(5)反应⑧的化学方程式为
;(5)反应⑧的化学方程式为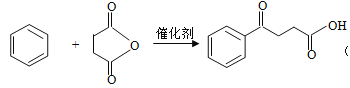 。
。

 期末集结号系列答案
期末集结号系列答案【题目】为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
物质 | 试剂 | 分离方法 | |
① | 乙烷(乙烯) | H2 | 催化剂加热 |
② | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 溴苯(Br2) | CCl4 | 萃取分液 |
A. ①② B. ①③ C. ③④ D. 只有③




