题目内容
用下图所示装置不能达到有关实验目的是

A.用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH) 2
C.用丙图装置制取金属锰
D.用丁图装置比较NaHCO3和Na2 CO3的热稳定性
【答案】
D
【解析】
试题分析:A、金属钠在水和煤油界面上下移动,证明密度关系符合答案,正确;B、氢氧化亚铁容易被氧气氧化,所以制备时应避免与空气接触,煤油覆盖在溶液表面和滴管插入液面以下均是防止氧气进入,正确;C、铝热反应可以制备熔点高的金属如锰等,正确;D、套管实验,加热时大管温度高小管温度低,温度高先分解不能得出正确答案,应把药品互换放置,错误。
考点:考查实验操作与实验原理有关问题。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
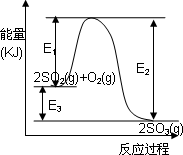
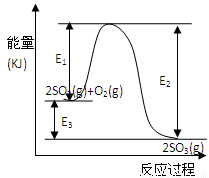
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。 SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)
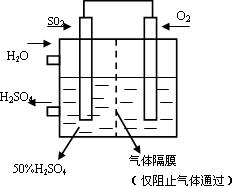
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为 。(1分)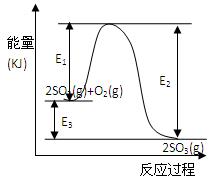
 SO3
SO3 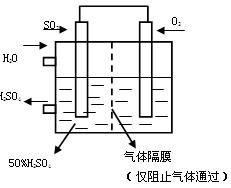
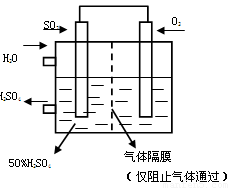
 O2和水的质量比为 (2分)
O2和水的质量比为 (2分)
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。