题目内容
 (1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:
(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:Al
Al
,负极发生:氧化
氧化
反应(填“氧化”或“还原”);正极为铂网,电流
电流
(填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向正极
正极
(填“正极”或“负极”).若电路中转移3mol电子,则负极材料质量减少
27
27
克(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2=2H2O.酸式氢燃料电池的电解质是酸、其负极反应为:2H2-4e-=4H+,则正极反应为
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-=4OH-,则负极反应为:
2H2-4e-+4OH-=4H2O
2H2-4e-+4OH-=4H2O
.(3)如右图:若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为
正
正
极(填正或负),写出电极反应式:正极2Fe3++2e-=2Fe2+
2Fe3++2e-=2Fe2+
负极Fe-2e-=Fe2+
Fe-2e-=Fe2+
.分析:(1)根据电池反应式判断正负极;根据得失电子判断反应类型;根据电子流向判断电流流向及离子移动方向;根据参加反应的负极材料与转移电子的关系计算;
(2)根据电池反应式=正极反应式+负极反应式,写出正极反应式或负极反应式;
(3)根据电极材料的活泼性判断正负极;根据得失电子写出相应的电极反应式;
(2)根据电池反应式=正极反应式+负极反应式,写出正极反应式或负极反应式;
(3)根据电极材料的活泼性判断正负极;根据得失电子写出相应的电极反应式;
解答:解:(1)根据反应方程式知,负极是Al,负极失电子发生氧化反应;正极为铂网,电子从负极经外电路到正极,电流正好相反,从正极经外电路到负极;正极上聚集大量电子,根据异性相吸,所以钠离子移向正极.
4A1+3O2+6H2O=4A1(OH)3转移电子
4×27g 12mol
27g 3mol
故答案为:Al;氧化;电流;正极;27.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O;2H2-4e-+4OH-=4H2O.
(3)根据正负极材料的活泼性知,铁片作负极,铜片作正极;正极上 Fe3+得电子生成Fe2+,所以电极反应式为
2Fe3++2e-=2 Fe2+;负极上铁失电子生成Fe2+,所以电极反应式为Fe-2e-=Fe2+.
故答案为:正;2Fe3++2e-=2 Fe2+;Fe-2e-=Fe2+.
4A1+3O2+6H2O=4A1(OH)3转移电子
4×27g 12mol
27g 3mol
故答案为:Al;氧化;电流;正极;27.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O;2H2-4e-+4OH-=4H2O.
(3)根据正负极材料的活泼性知,铁片作负极,铜片作正极;正极上 Fe3+得电子生成Fe2+,所以电极反应式为
2Fe3++2e-=2 Fe2+;负极上铁失电子生成Fe2+,所以电极反应式为Fe-2e-=Fe2+.
故答案为:正;2Fe3++2e-=2 Fe2+;Fe-2e-=Fe2+.
点评:本题考查了原电池工作原理及正负极电极反应式的书写,若已知总反应式和一个电极反应式,写另一个电极反应式,可根据电池反应式=正极反应式+负极反应式,书写另一个电极反应式(但必须得失电子数相等).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2PbSO4+2H2O放电时,正极电极反应式
2PbSO4+2H2O放电时,正极电极反应式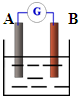
 2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.
2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.