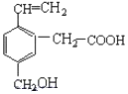
题目内容
【题目】(1)有机物若完全燃烧生成CO2和H2O,或不完全燃烧生成CO、CO2、H2O。则此有机物含有元素的组成情况 (填元素符号)。
(2)某有机物ag与0.8mol O2在密闭容器中充分混合后点燃。待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g。余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收)。请回答下列问题:
①通过计算确定该有机物化学式为 。
②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式 。
③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式 。
(已知① 醚不与钠反应 ②一个碳原子上同时连2个或多个羟基是不稳定的)
【答案】(1)C、H或C、H、O (全对2分)
(2)①C2H6O2 ②![]() ③CH3—O—CH2—OH
③CH3—O—CH2—OH
【解析】试题分析:化学反应中元素守恒可知该有机物组成情况有C、H或C、H、O。通过足量澄清石灰水,产生40g白色沉淀,题中沉淀全是碳酸钙,40克。根据反应式可得有0.4摩尔的二氧化碳,0.4摩尔的氢氧化钙。而原液只减轻了0.8克,除二氧化碳与氢氧化钙反应产生的水(0.4摩尔),沉淀碳酸钙=0.4mol 因此二氧化碳=0.4mol 有机物产生的水的质量=40-0.8-0.4*44=21.6 因此H2O=1.2mol, H是2.4mol..再由余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出,可知11.2克为二氧化碳物质的量与氧气的质量差,从而可算出通过灼热氧化铜产生的二氧化碳,再据碳原子个数守恒可算出,该有机物与氧气反应生成的一氧化碳的量即0.4mol。再由原子个数守恒可知有机物中氧原子物质的量为1.2*1+0.4*2+0.4*1-0.8*2=0.8.因此该有机物碳、氢、氧的原子个数比为0.8:2.4:0.8=1:3:1所以该有机物化学式为C2H6O2,再由质量守恒可算出该有机物a的质量为1.2*18+0.4*44+0.4*28-0.8*32=24.8克即物质的量为24.8除以62等于0.4mol,,而18.4g金属钠即为0.8mol,由此可知该物质为乙二醇,同样的计算方法可知0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式CH3—O—CH2—OH

 名校课堂系列答案
名校课堂系列答案【题目】某化学活动小组设计以下装置进行不同的实验。
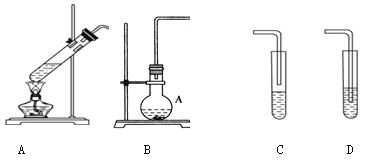
已知苯、溴苯的有关物理性质如下表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(1)若小组同学欲用装置A、C制备溴苯,则A中反应的方程式____________, A处长导管的作用是冷凝回流,回流的主要物质有______________________(填化学式)实验结束后,向A中依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯,NaOH溶液洗涤的作用是____________;若进一步提纯粗产品,依次进行的实验操作名称是___________、__________。
(2)若小组同学欲在B 装置中用正丁醇、冰醋酸合成一种水果香精,则还需连接的装置是________(填序号),该装置中应加入试剂________。反应结束后,取下收集装置充分振荡后静置,分去水层,可得乙酸正丁酯粗产品。现要回收水层中的有机物,依次进行的实验操作名称及相关试剂为________、________、__________。