题目内容
15.用含少量铁的氧化物的氧化铜制取硫酸铜晶体(CuSO4•xH2O).有如图甲操作: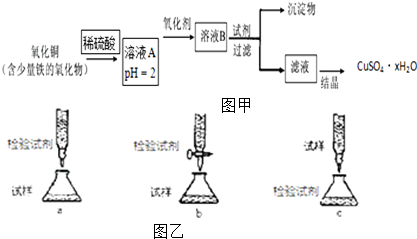
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.能检验溶液A中Fe2+的试剂为a(填编号,下同).
a.KMnO4 b.(NH4)2S c.NaOH d.KSCN
(2)欲用(1)中选择的检验试剂测定溶液A中Fe2-的浓度,如图乙的滴定方式中(夹持部分略去),最合理的是b(填序号)写出滴定反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++2H2O
(3)在上述流程中,要得到较纯的产品,试剂可选用cde.
a.NaOH b.FeO c.CuO d.Cu(OH)2 e.Cu2(OH)2CO3
(4)为了测定制得的硫酸铜晶体(CuSO4•xH2O)中x的值,某兴趣小组设计了实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng.据此计算得x=$\frac{40(m-2n)}{9n}$(用含m、n的代数式表示).
分析 用含少量铁的氧化物的氧化铜加入稀硫酸可得到溶液A含有Fe3+、Fe2+、Cu2+,调节溶液pH=2并加入氧化剂可将Fe2+氧化生成Fe3+,加入试剂CuO、Cu(OH)2 或Cu2(OH)2CO3,调节溶液pH使Fe3+生成氢氧化铁沉淀而除去,过滤后滤液为硫酸铜溶液,经蒸发结晶可得到硫酸铜晶体,以此解答该题.
解答 解:用含少量铁的氧化物的氧化铜加入稀硫酸可得到溶液A含有Fe3+、Fe2+、Cu2+,调节溶液pH=2并加入氧化剂可将Fe2+氧化生成Fe3+,加入试剂CuO、Cu(OH)2 或Cu2(OH)2CO3,调节溶液pH使Fe3+生成氢氧化铁沉淀而除去,过滤后滤液为硫酸铜溶液,经蒸发结晶可得到硫酸铜晶体,
(1)Fe2+具有还原性,可被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,与KSCN不反应,加入硫化铵、氢氧化钠溶液可生成CuS、氢氧化铁、氢氧化铜沉淀而不能检验Fe2+,只有a正确,
故答案为:a;
(2)用高锰酸钾测定溶液A中Fe2-的浓度,因高锰酸钾具有强氧化性,应放在酸式滴定管中,发生反应的离子式为5Fe2++MnO4-+8H+=5Fe3++Mn2++2H2O,
故答案为:b;5Fe2++MnO4-+8H+=5Fe3++Mn2++2H2O;
(3)溶液B中含有Fe3+、Cu2+,为除去Fe3+,可加入试剂CuO、Cu(OH)2 或Cu2(OH)2CO3,调节溶液pH使Fe3+生成氢氧化铁沉淀而除去,避免引入新杂质,
故答案为:cde;
(4)称取mg硫酸铜晶体,加入足量氢氧化钠溶液生成氢氧化铜、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,最后得到沉淀为CuO,质量为ng,则n(CuO)=$\frac{n}{80}$mol,
则n(CuSO4)=n(CuO)=$\frac{n}{80}$mol,
m(CuSO4)=$\frac{n}{80}$mol×160g/mol=2ng,
m(H2O)=(m-2n)g,
n(H2O)=$\frac{m-2n}{18}$mol,
x=$\frac{n(H{\;}_{2}O)}{n(CuSO{\;}_{4})}$=$\frac{\frac{m-2n}{18}}{\frac{n}{80}}$=$\frac{40(m-2n)}{9n}$,
故答案为:$\frac{40(m-2n)}{9n}$.
点评 本题考查物质的制备,为高频考点和常见题型,侧重于学生的分析、实验和计算能力得到考查,注意把握实验的原理以及物质的性质,为解答该类题目的关键,注意掌握实验基本操作和流程分析,题目难度中等.

| A. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| B. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| C. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
| A. | NH4+ K+ NO3- Cl- | B. | NO3- CO32- K+ Na+ | ||
| C. | K+ Na+ Cl- SO42- | D. | Mg2+ Cu2+ SO42- Cl- |
| A. | 1 L 1mol/L CH3COONa溶液中存在NA个CH3COO-离子 | |
| B. | 在标准状况下,22.4LSO3含有3NA个氧原子 | |
| C. | 1 mol Cl2参加化学反应获得的电子数都是2NA | |
| D. | 1 mol NO2气体降温后颜色变浅,其所含的原子数仍为3NA |

| A. | AB为气体,A2,B2均为气体 Q>0 | |
| B. | AB为气体,A2,B2其中有一种为气体,Q<0 | |
| C. | AB为气体,A2,B2其中有一种为气体,Q>0 | |
| D. | AB为气体,A2,B2其中至少有一种为气体,Q>0 |
| X | Y | ||
| Z | Q | W |
(2)W、Q的最高价氧化物对应的含氧酸的酸性:HClO4>H2SO4(用化学式表示,下同)
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=+11035.2kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6kJ•mol-1 |
 ,写出E的氢化物的分子式:H2O、H2O2.
,写出E的氢化物的分子式:H2O、H2O2.