题目内容
关于热化学方程式:2H2(g)+02(g)=2H20(1)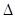 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
A.2mol H2完全燃烧生成液态水放出571.6 kJ的热
B.1mol H2完全燃烧生成液态水时放出285.8kJ的热
C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D.上述热化学方程式可表示为H2(g)+1/2
O2(g)=H20(1),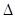 H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
【答案】
C
【解析】
试题分析:根据氢气燃烧的热化学方程式可知,2mol H2完全燃烧生成液态水放出571.6 kJ的热量,A正确;同样1mol H2完全燃烧生成液态水时放出的热量是571.6 kJ ÷2=285.8kJ,B正确;C不正确,因为化学计量数表示的是参加反应的物质的物质的量,不是分子数;反应热与化学计量数成正比,因此选项D也正确的,答案选C。
考点:考查热化学方程式的有关判断和反应热的计算
点评:该题是基础性试题的考查,主要是考查学生对热化学方程式含义以及反应热与化学计量数关系的了解掌握情况,意在培养学生灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目
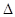 H=-571.6 kJ·mol-1,下列有关叙述不正确的是
H=-571.6 kJ·mol-1,下列有关叙述不正确的是